
토끼 방향특이성 망막 신경절세포의 니코티닉 아세틸콜린 수용체 α7과 β4 소단위의 위치 측정

초록
성체 토끼 방향특이성 망막 신경절세포의 수상돌기에서의 nAChR α7 and β4 소단위의 존재와 분포에 대해서 연구를 시행하였다.
방향특이성 망막신경절세포의 수상돌기의 형태를 확인하기 위해 Lucifer yellow를 세포에 주사하였다. 토끼 망막의 방향특이성 망막신경절세포의 수상돌기상에 있는 nAChR α7와 β4 소단위는 면역조직화학법을 사용하여 확인하였다. 수상돌기와 nAChR 소단위의 이중 이미지는 고해상도의 공초점현미경을 사용하여 분석하였다.
방향특이성 신경절세포 수상돌기의 ON층과 OFF층 모두 nAChR α7 and β4 소단위 의 분포는 비대칭적인 패턴을 보이지 않았다.
본 연구는 방향특이성 신경절세포의 수상돌기에 있는 nAChR 소단위의 분포 패턴이 성체 토끼 망막에서 비대칭이 아니라는 것을 시사하지만, 콜린성 입력의 방향 선택성에 대한 해부학적 증거를 제공하고 있다.
Abstract
We investigated the existence and distribution of the nicotinic acetylcholine receptor (nAChR) α7 and β4 subunits on the dendritic arbors of direction-selective retinal ganglion cells (DSRGCs) in the adult rabbit retina.
DSRGCs were injected with 5% Lucifer yellow to identify their dendritic morphology. The nAChR α7 and β4 subunits on the dendritic arbors of the DSRGCs in the adult rabbit retina were identified using immunocytochemistry. The double-labeled images of dendrites and nAChR α7 and β4 subunits were visualized for reconstruction using high-resolution confocal microscopy.
The distribution of nAChR α7 and β4 subunits on dendritic arbors in both the ON and OFF layers of the DSRGCs did not reveal an asymmetrical pattern in adult animals.
Although the present study suggests that the distributional pattern of the nAChR α7 and β4 subunits on the dendritic arbors of the DSRGCs was not asymmetric in the adult rabbit retina, the findings provide anatomical evidence of nAChR subunits for direction selectivity of cholinergic input.
Keywords:
Nicotinic Acetylcholine Receptor, Direction Selectivity, Retinal Ganglion Cell, Immunocytochemistry, Cell Injection키워드:
니코니틱 아세틸콜린 수용체, 방향특이성, 망막신경절세포, 면역조직화학법, 세포주사서 론
망막에는 40종류 이상의 고유한 유형의 망막 신경절세포(retinal ganglion cell)들이 존재하며 각각의 신경절세포들은 색상, 모양 및 동작 방향과 같은 개별적인 시각적 특징들을 인코드(encode) 한다.[1,2] 시각적 움직임의 방향을 인코딩하는 기능을 ‘방향선택(direction-selective)’이라고 하며 그 역할을 하는 신경절세포를 방향특이성 신경절세포(direction selective retinal ganglion cell, DSRGC)라고 한다. 방향특이성 신경절세포는 외부에서 전달되는 정보에서 움직이는 사물을 감지하여 시각피질에 운동정보를 제공하고 이를 통해 반사적인 안구 운동과 적절한 신체 반응을 할 수 있다.[3,4] 방향특이성이란 정방향(preferred direction)으로 움직이는 물체에는 강하게 반응하고, 반대방향(null direction)으로 움직이는 물체에 대해서는 반응이 일어나지 않는 특성으로 1965년 Barlow와 Levick의 방향특이성에 대한 첫 발표를 시작으로 방향특이성에 대한 여러 연구들이 진행되고 있다.[5] 망막에서 방향특이성 신경절세포가 발견된 지 반세기가 지났지만 아직도 방향특이성 신경절세포가 방향의 속도와 방향을 세포수준에서 어떻게 계산하는지는 여러 부분에서 알려져 있지 않다.[6-8]
방향특이성 신경절세포의 기작에 대해서는 방향특이성이 망막신경절세포 이전 수준에서 결정된다는 Presynaptic model과 망막신경절세포 수상돌기(dendrite)내에서 일어난다는 Postsynaptic model로 제시되고 있다.[9,10] 방향특이성이 망막신경절세포 이전 수준에서 결정된다는 것은 이극세포(bipolar cell)와 무축삭세포(amacrine cell)의 신호에 의해 결정된다는 것이며, 망막의 성상 무축삭세포(starburst amacrine cell)에서 방출되는 억제성 신경전달물질인 γ-아미노부티르산(γ-aminobutyric acid, GABA)이 망막신경절세포의 방향특이성에 관여한다고 알려져 있다.[11-13] 방향특이성 신경절세포는 이극세포부터 글루타메이트(glutamate)와 성상 무축삭세포로부터 아세틸콜린(acetylcholine) 흥분 입력을 받는다.[8,14] 최근 연구는 방향특이성이 방향특이성 신경절세포에서 흥분과 억제(excitation and inhibition) 사이의 시간 균형에서 비롯될 수 있음을 시사하며, 이는 성상 무축삭세포의 응답 타이밍이 방향 선택성을 지시함을 의미하고 있다. 방향특이성이 망막신경절세포 이전 수준에서 결정되는 것인지 망막신경절세포의 수상돌기에서 결정되는 것인지에 대한 연구는 이어지고 있으며 성상형 무축삭세포가 방향특이성 결정에 영향을 준다는 가설에 더 무게가 실리고 있다.[13,16]
따라서 방향특이성 신경절세포의 방향특이성 기작을 이해하기 위해 시냅스 수준에서 방향특이성 신경절세포의 수상돌기에서 신경전달물질의 수용체들이 어떤 형태의 패턴으로 존재하는지 그 발현 양상에 대해 연구할 필요가 있다. 이온성 아세틸콜린 수용체(ionotropic acetylcholine receptors)인 니코티닉(nicotinic) 아세틸콜린 수용체 소단위(nAChR subunit)는 α(α2-α10)와 β(β2-β4)가 존재하며,[17] 다양한 소단위들이 망막과 시각피질에 존재하고 있다. β4 nAChR 소단위는 망막의 특정세포 아형(subpopulation)에서 발현되어지며,[18] α7 소단위를 제거한 유전자 결손 쥐에서는 시력이 감소되는 것을 볼 수 있는데 이는 nAChR의 부재로 인해 발생되었다. nAChR 소단위는 시각과 중요한 관계성이 있음을 알 수 있다.[19] 이러한 신경전달물질 수용체의 시냅스 패턴 연구를 통해 방향특이성의 기작을 이해하는데 기초자료를 제공할 수 있다. 본 연구자들은 이전 연구에서 nAChR α4와 β2 소단위의 망막신경절세포 수상돌기에 분포하는 패턴에 대해 연구를 진행을 하였으며[20] 본 연구에서는 아세틸콜린 수용체 중 nAChR α7과 β4 소단위의 공간적 분포 패턴을 알아보기 위해 연구하였다.
대상 및 방법
1. 실험 준비 및 망막 분리
실험 24시간 전 뉴질랜드 흰 토끼를 ketamine hydrochloride(75 mg/kg)와 xylazine(15 mg/kg) 혼합물 이용하여 마취하였고, 망막 신경절세포를 찾기 위해 핵 염색 물질인 4',6-diamidino-2-phenylindole(DAPI) 10 μg을 안구내로 주입하였다. DAPI 주입 24시간 뒤 재마취하여 안구를 적출 한 후 적도 부분에서 반으로 자르고, 수정체와 유리체를 분리하여 제거하였다. 망막 적출의 전체 과정은 Ames' medium(Sigma-Aldrich, USA) 안에서 시행하였으며, 분리된 망막은 산소 95%와 이산화탄소 5%로 유지되는 Ames' medium(Sigma-Aldrich, USA)에서 살아있는 상태가 유지되게 하였다.[21] 동물 실험과정은 Use of Animals in Ophthalmic and Vision Research의 ARVO Statement 가이드에 따랐다.
2. 살아있는 세포 주사기법
분리된 망막은 10분간 DAPI 잔류물을 제거하기 위해 Ames' medium에서 세척단계를 거치고 난 후 Millipore filter paper(0.45 μm, Black, HABP 47 mm, Millipore, USA)에 신경절세포를 위쪽 방향으로 펼친 후 superfusion chamber로 옮겨 실험을 수행하였으며 망막을 살아있는 상태로 지속시키기 위해서 Ames' medium으로 계속 관류시켜주었다. 망막 조직은 Zeiss fixed stage fluorescence 현미경에 특수 제작한 스테이지에 mounting 한 후 5% Lucifer yellow를 미세전극에 채운 후 전류 발생기를 이용하여 주사하였으며, 이 방법은 이 실험방법을 처음으로 개발한 Dr. Masland의 방법을 따랐다.[22] 방향특이성 신경절세포는 큰 세포체와 신장모양의 핵을 가지고 있어서 다른 신경절세포와 구분이 가능하여 현미경 상에서 세포체 형태를 확인하여 살아있는 세포에 방향특이성 신경절세포를 선택적으로 주사할 수 있다.[23]
3. 형광 면역조직화학법
방향특이성 신경절세포에 Lucifer yellow를 주입한 후망막은 고정액(4% paraformaldehyde in 0.1 M phosphate buffer pH 7.4)에서 2시간동안 고정시켰다. ON-OFF 방향 특이성 신경절세포 상의 nAChR α7과 β4를 확인하기 위해 1차 항체로 anti nAChR subunits α7(1:100-200, Santa Cruz Biotechnology, USA)과 β4(1:100-200, Santa Cruz Bio-technology, USA)을 이용하였으며, 2차 항체로 Cy5-conjugated goat anti-rabbit IgG(1:50, Jackson Immuno-Research Labora-tories, USA)를 이용하였다. 형광 면역조직화학법이 단계를 마친 조직은 Vectashield mounting medium(Vector Laboratories, USA)을 이용하여 슬라이드를 고정하였다. nAChR α7과 β4의 분포를 살펴보기 위해 일부 망막들은 Millipore filter paper에 신경절세포층(ganglion cell layer)을 위로 오게 한 후 2시간동안 고정을 하였다. 이후 4% agarose gel을 이용하여 포매(embedding)한 후, 수직단면의 분포를 관찰하기 위해 Vibratome(Vibratome 3000, The Vibratome Company, USA)을 이용해서 50 μm 두께로 coronal section 한 뒤 형광 면역조직화학법을 실시하였다. 음성대조군 실험은 망막 조직을 1차 항체 없이 면역조직화학법을 진행하였다.
결 과
ON-OFF 방향특이성 신경절세포의 수상돌기는 독특한 분지패턴을 가지는데 벌집모양 형태의 특징을 가지고 규칙적인 격자무늬를 만들면서 잔가지들이 closed loop을 형성하여 세포체를 향해 꺾여 있어 다른 타입의 신경절세포와 형태적 구별이 가능하다. 수상돌기는 ON층과 OFF층의 두 층에 걸쳐 뻗어있는 특이한 형태를 지니고 있는데 망막의 내망상층(inner plexiform layer, IPL)의 20%(sublaminar a) 및 70%(sublaminar b)지역에서 2개의 층으로 분포되어있다. Fig. 1은 Lucifer yellow를 주입한 방향특이성 신경절세포로 전체적인 형태에서 벌집모양의 특징적인 분지패턴을 확인할 수 있다. 본 연구에서는 이 두 개의 세포를 사용하여 nAChR α7(Fig. 1A)과 β4(Fig. 1B) 소단위의 시냅스 분포 패턴을 분석하였다.
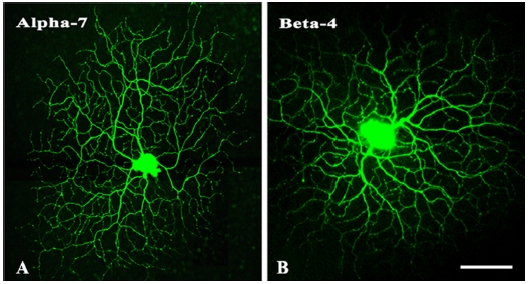
The unique shape of the direction-selective retinal ganglion cells (DSRGCs). In these photomicrographs, which are taken at a low magnification; both the ON and OFF dendritic arbors are visible. The two dendritic arbors in panels (A) and (B) are used to analyze the distributions of immunoreactivity for the nicotinic acetylcholine receptor (nAChR) α7 and β4 subunits, respectively. Bar=100 μm
nAChR α7과 β4 소단위의 망막 층 별 분포 위치를 분석하였다. Fig. 2는 망막 수직단면에서 nAChR α7과 β4 소단위의 면역반응반점(immunopuncta)을 나타낸 그림으로 대조군(Fig 2B, 2D)과 비교하였을 때 많은 면역반응반점이 관찰되며 대조군 조직에서는 어떠한 면역반응도 관찰되지 않았다. nAChR α7(Fig 2A)과 β4(Fig 2C) 소단위는 대부분 내망상층(IPL)과 신경절세포층(ganglion cell layer, GCL)층에 분포하고 있으며 외망상층(outer plexiform layer, OPL)과 내핵층(inner plexiform layer, INL)에서도 관찰되는 것을 확인하였다. 방향특이성 신경절세포의 수상돌기 ON층과 OFF층이 위치하는 망막의 층에 면역반응반점이 관찰되었다. 수직단면이 아닌 망막의 수평면에서의 면역반응반점을 확인하기 위해 망막 전체에서의 nAChR α7과 β4 소단위 면역반응반점을 확인하였다. 내망상층의 ON층과 OFF층 모두에서 nAChR α7(Fig 3A, 3B)과 β4(Fig 3C, 3D) 소단위가 존재하고 있음을 확인하였다.
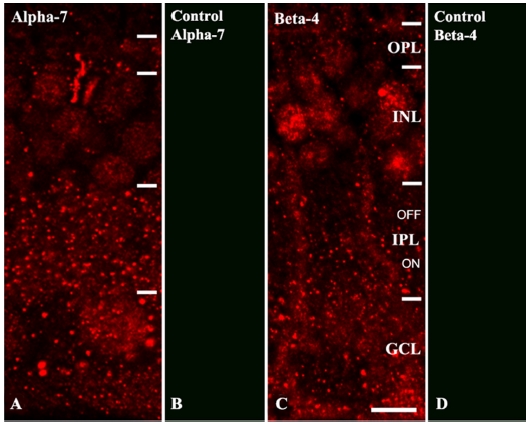
Immunoreactivity of the nicotinic acetylcholine receptor (nAChR) α7 and β4 subunits in vertical slices of the mid-peripheral rabbit retinas. Confocal micrographs demonstrate the immunopuncta labeled with antibodies against nAChR α7 (A) and nAChR β4 (C) subunits. Incubated vertical sections without the primary antibodies demonstrating no specific immunoreactivity (B, D). Bar=10 μm
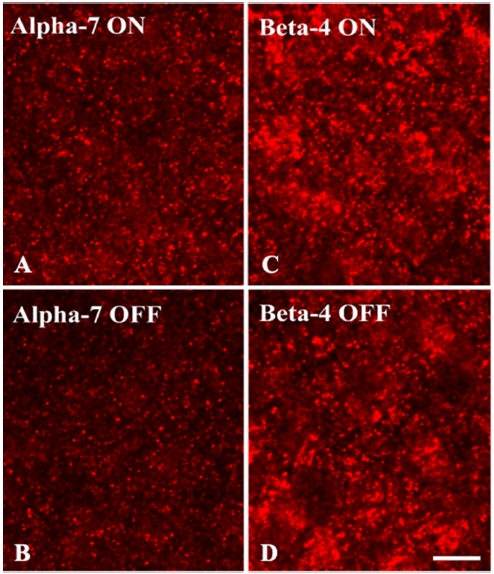
Fluorescence confocal micrographs of the mid-peripheral rabbit retinal whole mounts that are immunolabeled with antibodies against the nicotinic acetylcholine receptor (nAChR) α7 and β4 subunits. The images in panels (A) and (C) are taken from the ON layer, and the images in panels (B) and (D) are taken from the OFF layer. Bar=10 μm
방향특이성 신경절세포의 수상돌기에 위치하는 nAChR α7과 β4 소단위의 분포를 도식화 하였다(Fig. 4). 수상돌기의 전체 영역에서 위치하는 nAChR α7과 β4 소단위를 분석하였다. 검은색으로 표현된 수상돌기는 ON층(Fig. 4A, 4D)을 나타내고, 녹색으로 표현된 수상돌기는 OFF층(Fig. 4B, 4E)을 나타낸다. 붉은색 점은 ON층에 위치하고 있는 nAChR α7과 β4 소단위를 나타내고, 파란색 점은 OFF층에 위치하고 있는 nAChR α7과 β4 소단위를 나타낸 것이다. Fig. 4C와 4F는 ON-OFF층을 함께 병합시킨 이미지이다. ON층과 OFF층 모두 수상돌기의 특정 영역에 수용체 소단위가 비대칭적으로 존재하지 않고 nAChR α7과 β4 소단위가 전체 수상돌기에 고르게 분포하고 있음을 알 수 있다.
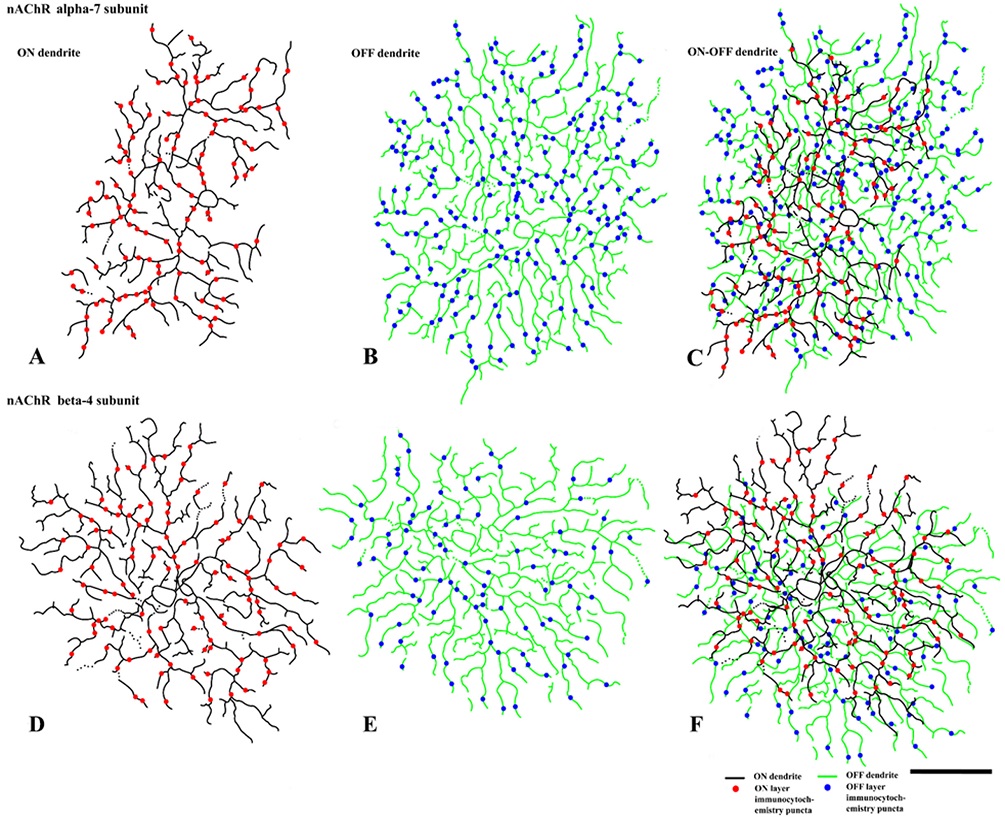
Reconstructed figures from digital photomicrographs illustrate the distributions of the nicotinic acetylcholine receptor (nAChR) α7 (A, B, C) and β4 (D, E, F) subunits on the ON (A, D, black line and red dots) and OFF (B, E, green line and blue dots) dendritic arbors of the direction-selective ganglion cells. Bar=100 μm
고 찰
방향특이성 신경절세포는 이극세포로부터 글루타메이트 입력과 성상 무축삭세포로부터 아세틸콜린 흥분 입력을 받는다.[3,13,26] 아세틸콜린 수용체중 하나인 니코틴성 아세틸콜린수용체(nicotinic acetylcholine receptors, nAChR)는 지금까지 척추동물의 뇌에 존재하는 12개의 nAChR 소단위가 확인되었는데 α(α2-α10)와 β(β2-β4) 소단위로 구성되어 있다.[27] 뇌에서 발견되어지는 가장 풍부한 아형은 α7 동형 및 α4β2 이형 nAChR이다.[28] α3β4β2 및 α2β4/α4β4 nAChR형도 다양한 중추신경계에서 발견되고 있다.[27] 망막에서 방향특이성 신경절세포의 기작에 대한 아세틸콜린의 역할을 이해하기 위해 nAChR를 차단한 연구에 따르면 방향 특이성에 대한 반응이 감소함을 알 수 있었다.[29] 또한 망막에서 α7 nAChR 아형은 망막의 신경절세포의 하위집단(subpopulation)에서 발현되면서 신경절세포 반응에 영향을 미치는 것으로 나타났다.[30] 특별히 방향특이성 신경절세포는 α7 nAChR를 발현하며,[25] α7 및 특정 non-α7 nAChR 소단위의 발현은 방향특이성 신경절세포의 선호방향과 관련이 있다.[31] 이러한 사실들은 중추신경계 망막에는 nAChR의 다양한 이질성과 복잡성(receptor heterogeneity and complexity) 들이 존재하는 것을 의미하고 있다.
신경전달물질 수용체의 시냅스 패턴 연구를 통해 방향특이성의 기작을 이해하기 위해 성체 토끼 망막의 ON-OFF 방향특이성 신경절세포 수상돌기 상에 위치한 nAChR α7와 β4 소단위(subunit)의 분포 패턴을 연구하였다. 이전 연구에서 nAChR α4와 β2 소단위의 발현에 대해 연구를 진행한 결과 토끼 망막의 ON-OFF 방향특이성 신경절세포의 수상돌기에서 비대칭적인 분포(asymmetric distribution)는 나타나지 않았다.[20] 본 연구에서 nAChR α7와 β4 소단위의 분포 패턴을 확인한 결과 수용체의 비대칭적 분포는 ON-OFF층 모두에서 역시 발견되지 않았다. 이와 아울러 N-methyl-d-aspartate(NMDA), α-amino-3-hydroxy-5-methyl-4-isoxazole propionate(AMPA), kainate(KA) 수용체 패턴에 대한 연구에서도 수용체의 비대칭적인 해부학적 증거가 나타나지 않았다.[24,33-34] 이러한 연구결과들은 망막의 방향특이성 신경절세포의 수상돌기에 시냅스를 형성하는 이극세포 및 성상 무축삭세포의 다양한 흥분성 신경전달 수용체들은 비대칭적 분포를 이루고 있지 않다는 것을 가리키고 있다.
본 연구는 nAChR α7 및 β4 분포와 토끼 망막에서 방향특이성 신경절세포의 시냅스 회로망 패턴이 비대칭이 아니라는 해부학적 증거를 통해 방향특이성을 이해하는데 있어 기초적인 자료를 제시한다.
결 론
이번 연구를 통해 nAChR α7 및 β24 소단위의 방향특이성 신경절세포의 수상돌기에서 분포 유형(pattern)을 밝혔다. 성인 토끼 망막에 방향특이성 신경절세포의 수상돌기 ON-OFF 층 모두에서 비대칭적 시냅스 분포 유형(synaptic pattern)은 관찰되지 않았다. 이러한 결과는 방향 선택성의 메커니즘을 설명하는데 핵심적인 요소 중 하나인 성상 무축삭세포로부터 방향특이성 신경절세포로 전달되는 흥분성 입력에 대한 기본적인 정보를 제공하고, 앞으로 보다 광범위한 해부학적, 생리학적 분석을 통한 방향인식의 복잡한 세포기작을 이해하는데 도움을 줄 것이라 사료된다.
Acknowledgments
본 논문의 일부내용은 2004년도 유럽신경과학회 (Federation of European Neuroscience Societies) 학회에서 포스터로 발표되었음.
이 논문은 2019학년도 경북대학교 연구년 교수 연구비에 의하여 연구되었음.
References
-
Sanes JR, Masland RH. The types of retinal ganglion cells: current status and implications for neuronal classification. Annu Rev Neurosci. 2015;38:221-246.
[https://doi.org/10.1146/annurev-neuro-071714-034120]

-
Baden T, Berens P, Franke K, et al. The functional diversity of retinal ganglion cells in the mouse. Nature. 2016;529(7586):345-350.
[https://doi.org/10.1038/nature16468]

-
Vaney DI, Sivyer B, Taylor WR. Direction selectivity in the retina: symmetry and asymmetry in structure and function. Nat Rev Neurosci. 2012;13(3):194-208.
[https://doi.org/10.1038/nrn3165]

-
Stahl JS. Using eye movements to assess brain function in mice. Vision Res. 2004;44(28):3401-3410.
[https://doi.org/10.1016/j.visres.2004.09.011]

-
Barlow HB, Levick WR. The mechanism of directionally selective units in rabbit's retina. J Physiol. 1965;178(3):477-504.
[https://doi.org/10.1113/jphysiol.1965.sp007638]

-
Demb JB. Cellular mechanisms for direction selectivity in the retina. Neuron. 2007;55(2):179-186.
[https://doi.org/10.1016/j.neuron.2007.07.001]

-
Wei W. Neural mechanisms of motion processing in the mammalian retina. Annu Rev Vis Sci. 2018;4:165-192.
[https://doi.org/10.1146/annurev-vision-091517-034048]

-
Mauss AS, Vlasits A, Borst A, et al. Visual circuits for direction selectivity. Annu Rev Neurosci. 2017;40:211-230.
[https://doi.org/10.1146/annurev-neuro-072116-031335]

-
Borg-Graham LJ. The computation of directional selectivity in the retina occurs presynaptic to the ganglion cell. Nat Neurosci. 2001;4(2):176-183.
[https://doi.org/10.1038/84007]

-
Taylor WR, He S, Levick WR, et al. Dendritic computation of direction selectivity by retinal ganglion cells. Science. 2000;289(5488):2347-2350.
[https://doi.org/10.1126/science.289.5488.2347]

-
Briggman KL, Helmstaedter M, Denk W. Wiring specificity in the direction-selectivity circuit of the retina. Nature. 2011;471(7337):183-188.
[https://doi.org/10.1038/nature09818]

-
Yonehara K, Balint K, Noda M, et al. Spatially asymmetric reorganization of inhibition establishes a motion-sensitive circuit. Nature. 2011;469(7330):407-410.
[https://doi.org/10.1038/nature09711]

-
Ankri L, Ezra-Tsur E, Maimon SR, et al. Antagonistic center-surround mechanisms for direction selectivity in the retina. Cell Rep. 2020;31(5):107608.
[https://doi.org/10.1016/j.celrep.2020.107608]

-
Masland RH. The many roles of starburst amacrine cells. Trends Neurosci. 2005;28(8):395-396.
[https://doi.org/10.1016/j.tins.2005.06.002]

-
Sethuramanujam S, McLaughlin AJ, deRosenroll G, et al. A central role for mixed acetylcholine/GABA transmission in direction coding in the retina. Neuron. 2016;90(6):1243-1256.
[https://doi.org/10.1016/j.neuron.2016.04.041]

-
Poleg-Polsky A, Diamond JS. Retinal circuitry balances contrast tuning of excitation and inhibition to enable reliable computation of direction selectivity. J Neurosci. 2016;36(21):5861-5876.
[https://doi.org/10.1523/JNEUROSCI.4013-15.2016]

-
Zouridakis M, Zisimopoulou P, Poulas K, et al. Recent advances in understanding the structure of nicotinic acetylcholine receptors. IUBMB Life. 2009;61(4):407-423.
[https://doi.org/10.1002/iub.170]

-
Britto LR, Rogers SW, Hamassaki-Britto DE, et al. Nicotinic acetylcholine receptors in the ground squirrel retina: localization of the beta 4 subunit by immunohistochemistry and in situ hybridization. Vis Neurosci. 1994;11(3):569-577.
[https://doi.org/10.1017/S0952523800002479]

-
Origlia N, Valenzano DR, Moretti M, et al. Visual acuity is reduced in alpha 7 nicotinic receptor knockout mice. Invest Ophthalmol Vis Sci. 2012;53(3):1211-1218.
[https://doi.org/10.1167/iovs.11-8007]

-
Lee JS, Kim HJ, Ahn CH, et al. Expression of nicotinic acetylcholine receptor α4 and β2 subunits on direction-selective retinal ganglion cells in the rabbit. Acta Histochem Cytochem. 2017;50(1):29-37.
[https://doi.org/10.1267/ahc.16024]

-
Ames A 3rd, Nesbett FB. In vitro retina as an experimental model of the central nervous system. J Neurochem. 1981;37(4):867-877.
[https://doi.org/10.1111/j.1471-4159.1981.tb04473.x]

-
Yang G, Masland RH. Direct visualization of the dendritic and receptive fields of directionally selective retinal ganglion cells. Science. 1992;258(5090):1949-1952.
[https://doi.org/10.1126/science.1470920]

-
Yang G, Masland RH. Receptive fields and dendritic structure of directionally selective retinal ganglion cells. J Neurosci. 1994;14(9):5267-5280.
[https://doi.org/10.1523/JNEUROSCI.14-09-05267.1994]

-
Kwon OJ, Lee JS, Kim HG, et al. Identification of synaptic patterns of NMDA receptor subtypes upon direction-selective rabbit retinal ganglion cells. Curr Eye Res. 2016;41(6): 832-843.
[https://doi.org/10.3109/02713683.2015.1056378]

-
Kim HJ, Jeon CJ. Synaptic pattern of nicotinic acetylcholine receptor α7 and β2 subunits on the direction-selective retinal ganglion cells in the postnatal mouse retina. Exp Eye Res. 2014;122:54-64.
[https://doi.org/10.1016/j.exer.2014.02.021]

-
Sethuramanujam S, Awatramani GB, Slaughter MM. Cholinergic excitation complements glutamate in coding visual information in retinal ganglion cells. J Physiol. 2018;596(16):3709-3724.
[https://doi.org/10.1113/JP275073]

-
Hendrickson LM, Guildford MJ, Tapper AR. Neuronal nicotinic acetylcholine receptors: common molecular substrates of nicotine and alcohol dependence. Front Psychiatry. 2013;4:29.
[https://doi.org/10.3389/fpsyt.2013.00029]

-
Dani JA, Bertrand D. Nicotinic acetylcholine receptors and nicotinic cholinergic mechanisms of the central nervous system. Annu Rev Pharmacol Toxicol. 2007;47:699-729.
[https://doi.org/10.1146/annurev.pharmtox.47.120505.105214]

-
Grzywacz NM, Amthor FR, Merwine DK. Necessity of acetylcholine for retinal directionally selective responses to drifting gratings in rabbit. J Physiol. 1998;512(2):575-581.
[https://doi.org/10.1111/j.1469-7793.1998.575be.x]

-
Dmitrieva NA, Strang CE, Keyser KT. Expression of alpha 7 nicotinic acetylcholine receptors by bipolar, amacrine, and ganglion cells of the rabbit retina. J Histochem Cytochem. 2007;55(5):461-476.
[https://doi.org/10.1369/jhc.6A7116.2006]

-
Strang CE, Renna JM, Amthor FR, et al. Nicotinic acetylcholine receptor expression by directionally selective ganglion cells. Vis Neurosci. 2007;24(4):523-533.
[https://doi.org/10.1017/S0952523807070435]

-
Moretti M, Vailati S, Zoli M, et al. Nicotinic acetylcholine receptor subtypes expression during rat retina development and their regulation by visual experience. Mol Pharmacol. 2004;66(1):85-96.
[https://doi.org/10.1124/mol.66.1.85]

-
Jeong SA, Kwon OJ, Lee JY, et al. Synaptic pattern of AMPA receptor subtypes upon direction-selective retinal ganglion cells. Neurosci Res. 2006;56(4):427-434.
[https://doi.org/10.1016/j.neures.2006.08.011]

-
Kwon OJ, Kim MS, Kim TJ, et al. Identification of synaptic pattern of kainate glutamate receptor subtypes on direction-selective retinal ganglion cells. Neurosci Res. 2007;58(3):255-264.
[https://doi.org/10.1016/j.neures.2007.03.009]

