은 나노 입자 합성 및 울템안경테 코팅막의 항균성 평가

초록
본 연구에서는 은 나노 입자를 합성한 후 안경테 소재인 Ultem(polyetherimide: PEI)에 코팅하여 항균성과 코팅특성을 평가해 보고자 한다.
AgNO3(silver nitrate)와 PVP(polyvinylpyrrolidone)를 사용하여 은 나노 입자를 합성한 후 UV-visible spectrophotometer를 사용하여 특징적인 표면 플라즈몬 공명 흡수밴드를 확인하였다. 또한 SEM과 EDS를 사용하여 합성한 시료의 크기, 형태, 구성 성분을 분석하였다. 합성한 은 나노 입자는 아크릴레이트를 주재로 하는 코팅 바인더와 교반 후 안경테 소재인 Ultem기판에 코팅하고 코팅막의 특성과 항균성을 측정하였다.
은 나노 입자의 합성을 확인하기 위해 흡광도를 측정한 결과 약 400 nm 근방에서 최대 흡수 피크가 나타났다. 또한 합성시간이 증가할수록 피크가 더욱 높아지는 것을 확인할 수 있었다. SEM을 통해 확인한 은 나노 입자는 약 20~80 nm의 삼각형과 육각형 등의 결정으로 형성되어있었으며, EDS 분석 결과 시료의 구성 물질 중 은이 75.89%, 탄소가 24.11%로 나타나 은 나노 입자의 형성을 확인할 수 있었다. 또한 코팅막의 부착력과 항균성이 우수하게 나타났다.
합성한 은 나노 입자를 사용하여 안경테 소재인 Ultem에 코팅한 코팅막은 Escherichia coli용에 대한 우수한 항균성을 나타내어 항균 기능을 가진 안경테 제작의 가능성을 확인하였다.
Abstract
In this study, after synthesizing silver nanoparticles, they were coated on Ultem (polyetherimide: PEI), a material for eyeglass frame, to evaluate antibacterial properties and coating properties.
After synthesizing silver nanoparticles using AgNO3 (silver nitrate) and PVP (polyvinylpyrrolidone), a characteristic surface plasmon resonance absorption band was confirmed using a UV-visible spectrophotometer. In addition, the size, shape, and composition of the synthesized samples were analyzed using SEM and EDS. The synthesized silver nanoparticles were stirred with an acrylate-based coating binder, then coated on an Ultem substrate, a material for eyeglass frame, and the properties and antibacterial properties of the coating film were measured.
As a result of measuring the absorbance to confirm the synthesis of silver nanoparticles, a maximum absorption peak was observed around 400 nm. In addition, it was confirmed that the peak increased as the synthesis time increased. The silver nanoparticles confirmed through SEM were formed in triangular and hexagonal crystals of about 20 to 80 nm, and as a result of EDS analysis, 75.89% of silver and 24.11% of carbon were found in the sample, confirming the formation of silver nanoparticles. In addition,the adhesion and antibacterial properties of the coating film were excellent
The coating film coated on Ultem, a material for eyeglass frame using synthesized silver nanoparticles, showed excellent antibacterial properties against Escherichia coli, confirming the possibility of manufacturing eyeglass frame with antibacterial function.
Keywords:
Silver nanoparticles, Polyetherimide, Ultem, Antibacterial eyeglass frame coating키워드:
은 나노, Polyetherimide, 울템, 안경테 항균 코팅서 론
코로나 바이러스 팬데믹(Pandemic) 확산세로 개인 및 사회전반에서 세균과 바이러스 저감을 위한 위생 관리가 최고조화 되고 있다. 이로 인해 항균 및 살균 제품에 대한 소비자의 관심과 수요가 급증하고 있다.
Chen등 여러 연구에서는 COVID-19의 주요 감염 경로는 호흡기이지만 눈을 통한 감염의 우려도 제기하였다.[1,2] 눈의 결막은 병원체에 직접 노출되고 해부학적으로 비루관으로 연결되어 눈물기관을 통해 비강과 비인두 점막으로 옮겨져 호흡기 감염을 유발 할 수 있다는 것이다.[3,4] 이렇듯 외부로 노출된 눈은 세균과 바이러스에 직접적인 수용체 역할을 하는 통로가 된다. 한편 몇몇 연구에서 COVID-19 감염과 안경 착용 사이의 연관성을 알아본 결과 안경을 매일 착용하는 사람의 감염 비율이 낮았고, 이는 안경 착용이 부분적인 바이러스 장벽으로 작용해 감염 위험을 감소시킨다고 하였다.[5-7] 하지만 안경테는 착용 시 피부에 직접 접촉되며 피지, 땀, 손에 있는 세균의 전이, 외부환경으로부터의 세균과 바이러스 등에 의해 오염된다. Kim의 연구에서 안경 착용자 145명의 안경테에서 검출된 세균은 17종, 진균류는 5종으로 나타났으며 이러한 세균과 진균 등에는 안과질환을 일으키는 균이 포함되어 있었다.[8] 따라서 시대적 요구와 맞물려 항균기능을 갖춘 안경테 연구가 필요할 것이라 판단된다.
항균물질 중 은(Ag)은 고대부터 박테리아, 곰팡이 및 바이러스에 대한 광범위한 항균활성 뿐만 아니라 강력한 억제 및 살균효과가 있는 것으로 알려져 있다.[9,10] 은 나노(Ag0)는 최근 나노기술의 발전과 미생물에 뛰어난 불활성화 효과에 대한 연구 결과가 보고되면서 재료과학, 화학, 의학 등 다양한 분야에서 활발하게 연구, 사용되고 있는 항균물질이다.[11,12] 본 연구에서는 항균물질인 은 나노 입자를 합성하고 안경테 소재인 Ultem에 코팅하여 코팅막의 특성과 항균성을 평가해 보고자 한다.
대상 및 방법
1. 실험 준비
본 실험에 사용된 시약은 AgNO3(silver nitrate), PVP(polyvinylpyrrolidone average mol wt 40.000)는 Sigma-Aldrich 제품을 사용하였으며, 아크릴레이트를 주재료로 하는 2-methyl-2-propenoic acid methyl ester polymer with 2-methylhexyl 2-propenoate and 2-propenoic acid 코팅용액은 DAEWON POLYMER & CHEMICALS에서 제공받아 정제 없이 사용하였다.
사용된 기판은 안경테 소재인 Ultem(polyetherimide: PEI)을 가로 25 mm × 세로 25 mm × 두께 3T, 가로 50 mm × 세로 50 mm × 두께 3T로 제작하여 사용하였다. 기판의 전처리는 계면활성제를 푼 물에 담가 30분간 Ultrasonic cleaner로 초음파 세척한 후 증류수로 헹구어내고, 다시 Ethyl Alcohol에 담가 30분간 초음파 세척한 후 여러 차례 헹구어 냈다. 그런 다음 121oC의 Autoclave에서 15분간 고압 멸균한 후 완전히 건조하여 사용하였다.
항균 실험을 하기 위해 사용한 균주는 그람 음성균인 Escherichia coli(ATCC:10536)로 Korean Culture Center of Microorganisms에서 분양받아 사용하였고, 균 실험을 위해 사용한 액체배지는 BD사의 Peptone, Beef Extract, 고체배지는 BD사의 Peptone, Beef Extract, Agar를 사용하여 pH 7.0에 맞춰 제조하였으며, Autoclave를 사용하여 121oC에서 15분간 고압멸균 후 사용하였다. 또한 Escherichia coli용 3M Petrifilm과 직경 8 mm의 paper disc를 사용하였다.
실험에 사용되는 물은 3차 증류수를 사용하였으며, Ethyl Alcohol은 Extra Pure Grade로 Duksan 제품을 추가의 정제 없이 사용하였다.
2. Silver nanoparticles 합성
Silver nitrate를 0.1M 농도의 용액으로 준비하고 Polyvinylpyrrolidone을 10~17wt%로 준비한다. 준비된 PVP를 3차 증류수에 첨가하여 Vortex와 Ultrasonic cleaner를 이용해 잘 용해시킨 후 magnetic bar를 넣어 계속해서 stirring 하고 100oC 온도의 수조에서 Silver nitrate와 혼합하여 1시간 동안 합성하였다. 원심분리기(Eppendorf 5804R Germany)를 사용하여 14,000 rpm으로 10분간 원심분리하고 증류수로 세척하며 미반응 물질과 불순물을 제거하였다. 이 과정을 2~3회 반복하여 Silver nanoparticles 시료를 취하였다.
3. Silver nanoparticles의 특성 및 항균성 검사
초기 농도 0.1 M의 Silver nitrate와 PVP를 사용하여 Silver nanocolloids를 합성 시 반응시간에 따른 특성을 검사하기 위해 반응 직후, 10분, 20분, 30분, 40분, 50분, 60분 간격으로 UV-visible spectrophotometer(Evolution 201, Thermo scientific, USA)를 사용하여 흡광도를 측정하였다.
SEM(Scanning electron microscopy: Mira III, Tescan, Czech)을 사용하여 Silver nanoparticles의 형상과 크기를 확인하고, EDS(Energy dispersive x-ray spectroscopy)로 구성물질의 성분을 확인하였다. 이때 합성한 Silver nanopartlcles를 탄소 테이프에 분산시킨 후 Desiccator에서 24시간 동안 건조한 후 측정에 사용하였다.
합성한 Silver nanocolloids의 항균성을 알아보기 위해 Disk diffusion method를 실시하여 정성적 평가를 하였다. 이때 0.1M 농도의 질산은 수용액을 양성 대조군으로, 멸균된 증류수를 음성 대조군으로 사용하여 비교하였다. Escherichia coli(ATCC:10536)를 도말한 고체배지 위에 합성한 Silver nanocolloids와 대조군인 0.1 M 농도의 질산은 수용액, 멸균된 증류수를 60 μL씩 분주한 페이퍼 디스크를 올려 인큐베이터에서 35oC에서 24시간 배양하였다. 그런 다음 페이퍼 디스크 주위로 생성되는 균의 성장 억제 영역을 측정하여 항균성을 평가하였다.
4. 코팅 및 코팅막의 특성 검사
합성된 Silver nanocolloids를 2-methyl-2-propenoic acid methyl ester polymer with 2-methylhexyl 2-propenoate and 2-propenoic acid에 균일하게 혼합하여 안경테 소재인 Ultem 기판에 spin coating 하고 열 경화하였다.
코팅막의 평가를 위해 원자힘 현미경(AFM: Parker systems)을 사용하여 코팅막의 표면 지형과 거칠기를 알아보았다. 측정은 다른 위치에서 3번 측정하고 결과는 평균값으로 나타내었다.
코팅막의 부착력은 Cross-cut tape test로 ASTM D 3359-02에 근거하여 측정하였다. 코팅 처리한 기판 표면을 면도칼을 사용하여 1 mm 간격으로 가로, 세로방향으로 각각 6줄의 선을 그어 총 25개의 격자가 생기게 하였다. 3M사의 Scotch tape 610을 사용하여 cross cut 한 표면에 테이프를 접착한 후 일정한 힘을 사용하여 떼어내어 떨어져 나간 정도를 ASTM D3359-02 기준에 따라 판정하였다.[13-15] 박리 정도에 따라 박리가 없으면 5B, 5% 미만 4B, 5~15% 3B, 15~35% 2B, 35~65% 1B, 65% 초과 시 0B로 평가하였다.
5. 항균성 평가
코팅막의 항균성 검사는 JIS Z 2081규정을 참고하여 필름 밀착법으로 실시하였다. 이때 안경테 소재인 Ultem(Polyetherimide: PEI)기판 사이즈는 규정에 맞게 가로 50 mm, 세로 50 mm를 사용하여 항균 코팅 한 후 Escherichia coli(ATCC:10536)에 대한 코팅막의 항균성을 측정하였다.
코팅된 기판 위에 1.0 × 106 cfu/mL 농도의 균액 0.02 mL를 분주하고, 가로 40 mm, 세로 40 mm의 멸균된 폴리에틸렌필름을 올려 35oC에서 24시간 배양하였다. 그런 다음 멸균된 0.85%의 NaCl 10mL를 분주해 기판과 폴리에틸렌 필름표면에 부착된 균을 잘 헹구어낸 다음 그 액의 1 mL를 3 M Petrifilm에 분주하고 24시간 동안 Incubator 에서 배양하여 cfu(colony forming unit)를 측정 하였다. 결과는 아래와 같이 균 감소율로 나타내었다.
Ma : 대조편의 접종 직후의 생균수
Mb : 대조편의 24시간 배양 후의 생균수
Mc : 시험편의 24시간 배양 후의 생균수
결과 및 고찰
1. 합성한 Silver nanoparticles의 특성 분석
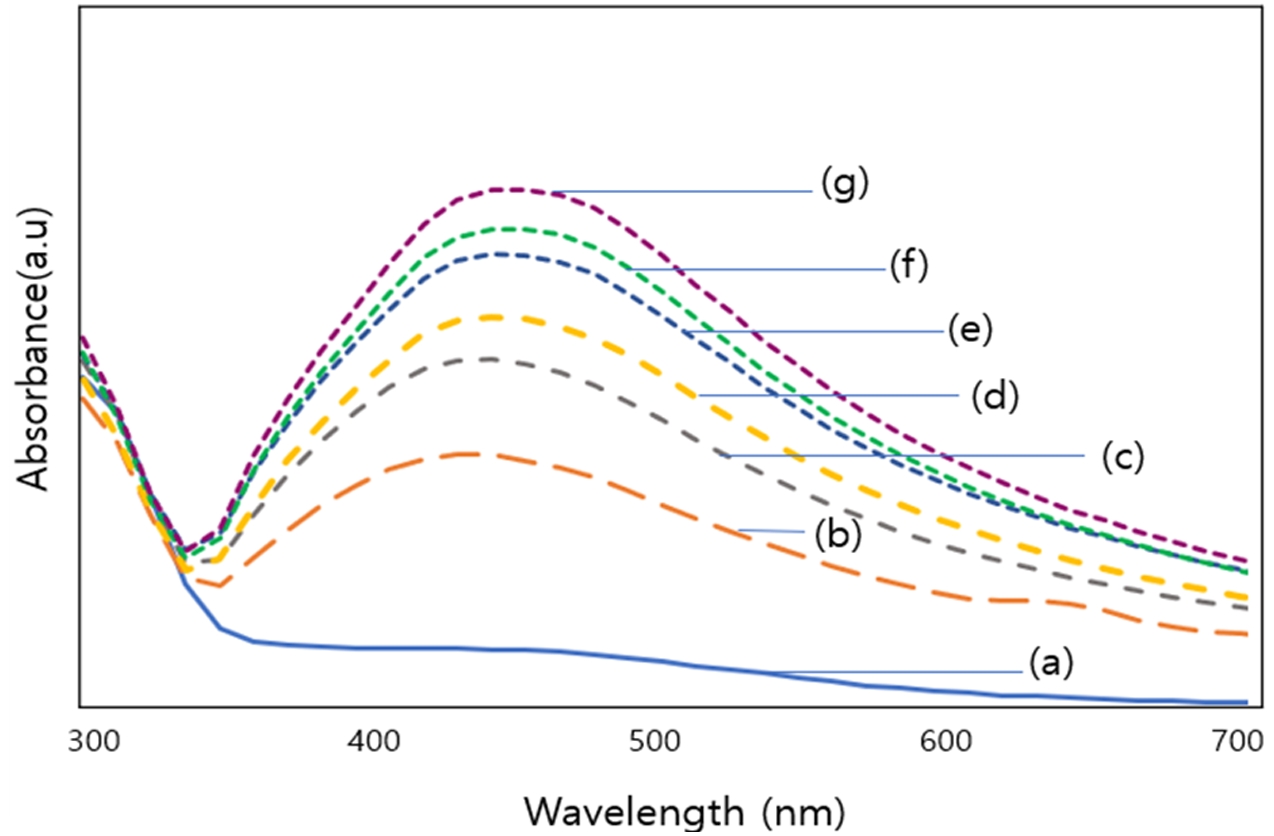
Silver nanopartlcles 합성을 확인하기 위해 흡광도를 측정한 결과 Fig. 1에서와 같이 0.1M 농도의 질산은 수용액 피크에 비해 합성이 일어난 후에 약 400 nm 영역대에서 최대 흡수 피크가 나타난 것을 확인할 수 있었다. 이는 Silver nanopartlcles의 UV-visible spectrophotometer에서의 표면 플라즈몬 흡수대가 약 400 nm 영역대에서 나타난다는 선행연구를 바탕으로 Silver nanopartlcles의 합성을 확인할 수 있었다.[16-18] Fig. 2는 합성 시간별 Silver nanopartlcles 형성의 경향성을 알아보기 위해 합성 시간을 10분 간격으로 하여 시료를 채취하고 흡광도를 찍은 결과이다. 이 결과를 보면 합성 시간이 증가할수록 Silver nanopartlcles의 특징적인 표면 플라즈몬 흡수대의 피크 강도가 점차 높아지고 적색 이동하는 것을 확인 할 수 있으며, 이는 Silver nanopartlcles의 입자의 크기와 농도 증가로 볼 수 있다.
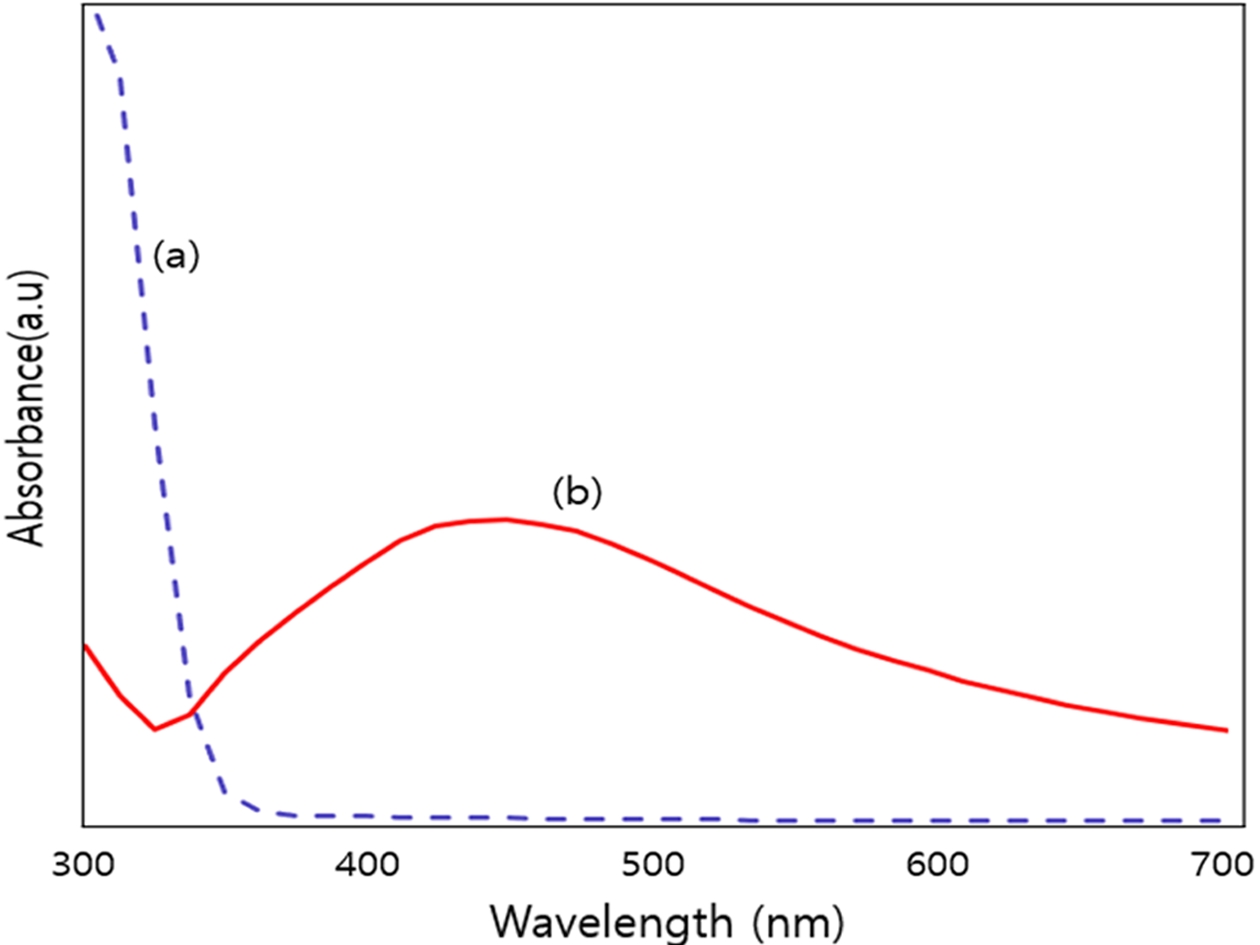
Comparison of absorbance before and after chemical reduction of silver nitrate.(a) The UV–vis spectrum of the silver nitrate solution with a concentration of 0.1 M(b) The UV–vis spectrum after the chemical synthesis
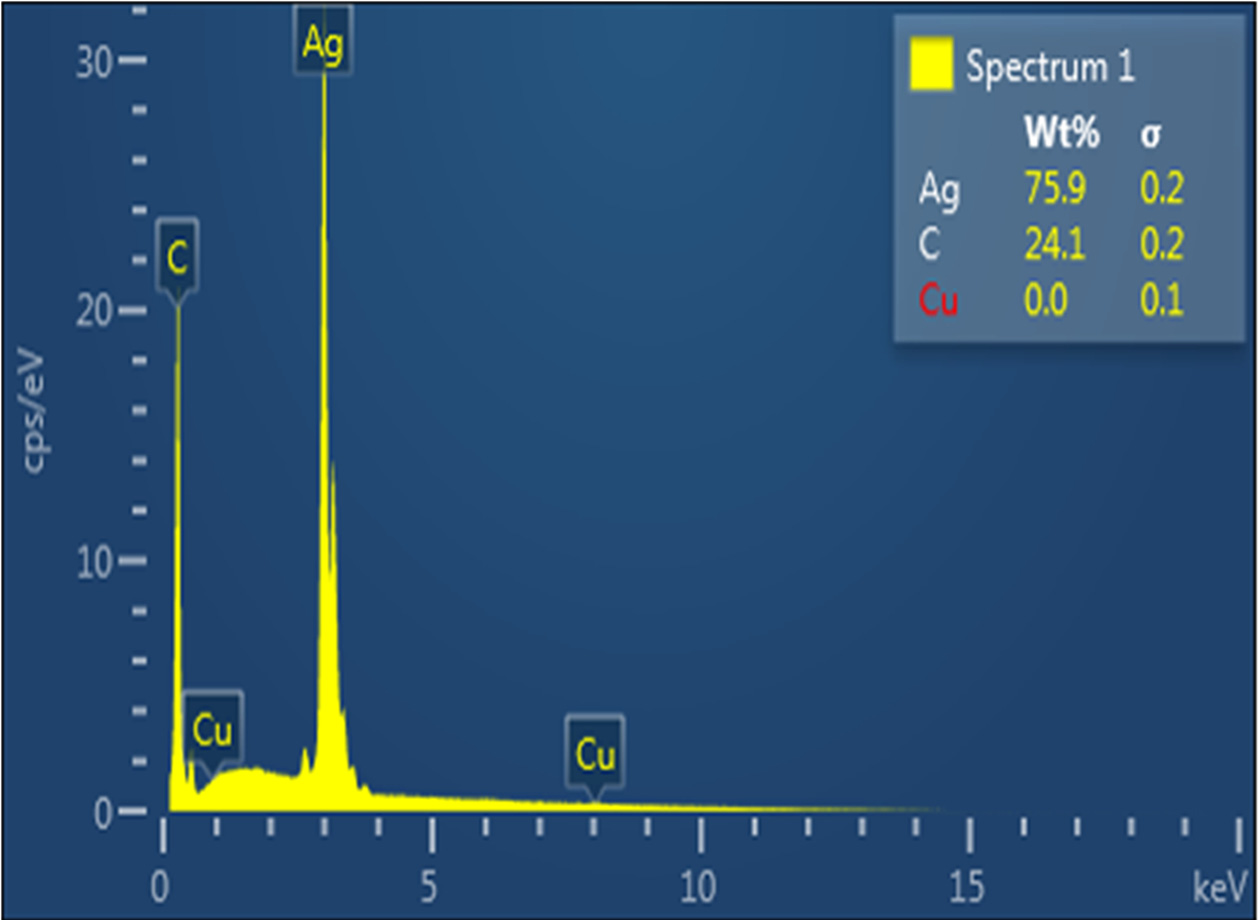
SEM과 EDS 측정 장비를 통해 합성한 Silver nanopartlcles의 형태, 크기, 원소성분을 분석한 결과 약 20~80 nm 크기의 구형, 삼각형, 육각형의 결정을 가지는 Silver nanopartlcles를 확인할 수 있었다.(Fig. 3) 또한 Fig. 4에서와 같이 EDS 분석 결과 은(Ag) 원자로부터의 강한 신호가 관찰되어 은(Ag)의 존재를 확인할 수 있었다. 시료의 구성물질에는 은이 75.89%, 탄소가 24.11%로 검출되었으며 이를 통해 Silver nanopartlcles의 형성을 확인할 수 있었다.(Table 1).
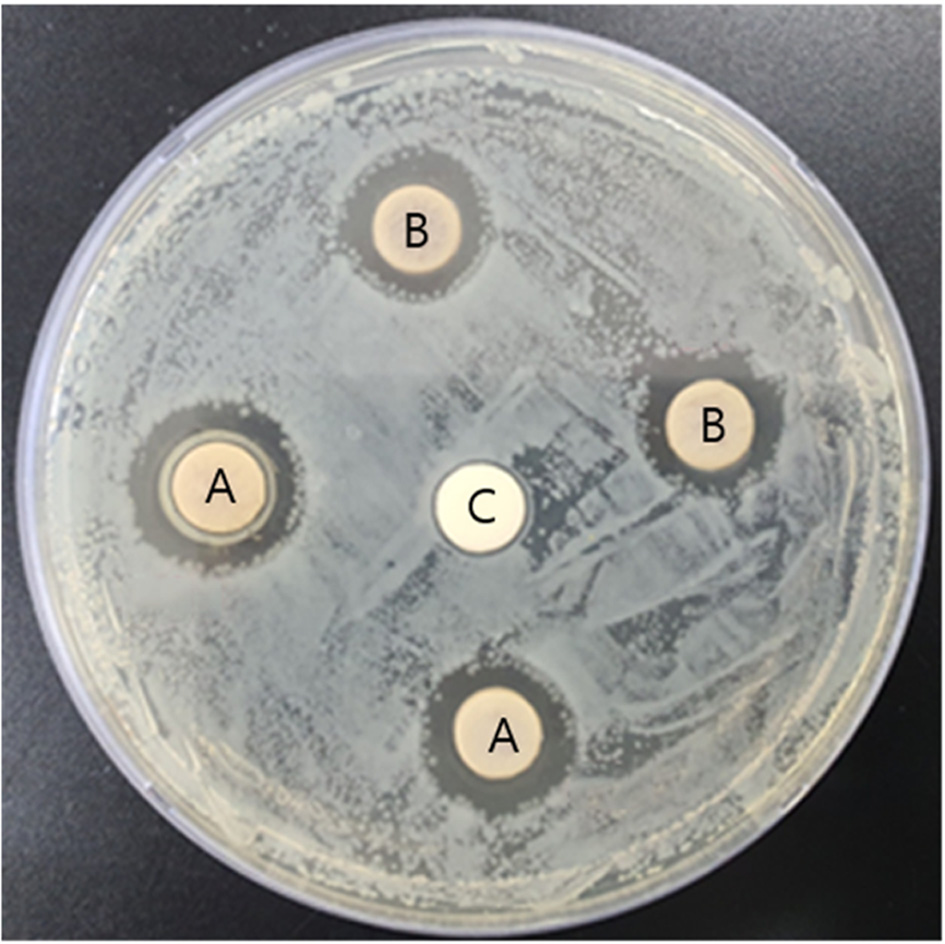
합성한 Silver nanocolloids의 항균력을 알아보기 위해 Disk diffusion method를 통해 균의 억제 영역을 확인한 결과 Fig. 5와 같이 음성 대조군인 멸균된 증류수를 분주한(C) Paper disk 주변에는 균 성장 억제 영역이 전혀 나타나지 않았으며, 양성 대조군인 0.1M 농도의 질산은 수용액을 분주한 (B) Paper disks 주변에는 8 mm의 Paper disk 직경 포함 약 12.6±0.38 mm의 균 성장 억제 영역을 확인할 수 있었다. 합성한 Silver nanocolloids를 분주한 (A) Paper disks 주변에는 균 성장 억제 영역이 약 14.4±1.0 mm로 나타나 Escherichia coli(ATCC:10536)에 대한 합성한 Silver nanocolloids의 항균성을 확인할 수 있었다.
2. 코팅막의 특성 평가
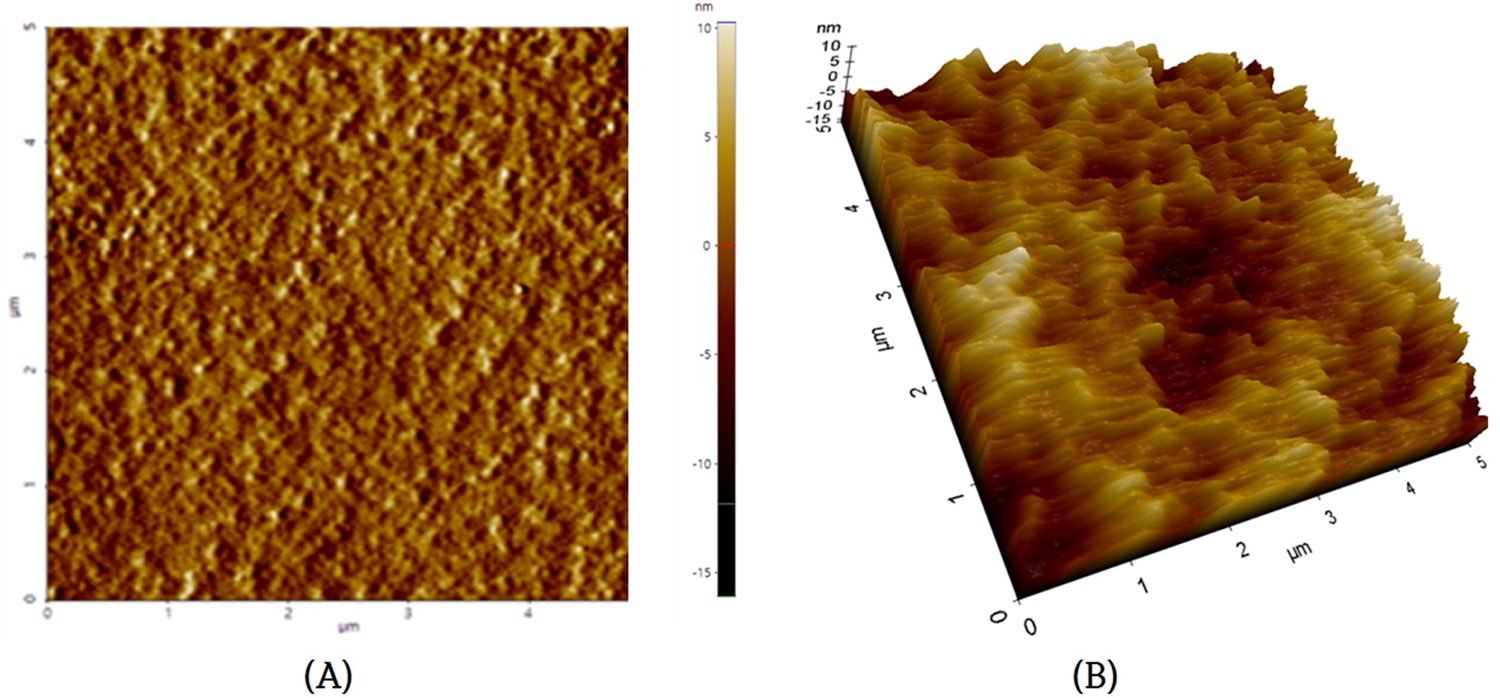
원자 힘 현미경으로 관찰한 코팅 박막 표면의 Power Spectrum Desity를 통해 표면의 주기적인 구조를 확인하였으며, 코팅 박막의 root mean square(RMS) 값을 분석한 결과 코팅하지 않은 기판의 RMS 값은 평균 9.808 nm, 코팅한 후의 RMS 값은 평균 3.627 nm로 측정되었다. 이는 코팅 후에 표면의 거칠기 즉 높낮이가 완만해진 것으로 볼 수 있으며 코팅 전 기판의 굴곡을 보완하여 코팅이 균일하게 잘 되었음을 확인할 수 있는 결과이다. Fig. 6.은 코팅한 기판의 RMS 값이 3.026 nm일 때의 이미지이다.
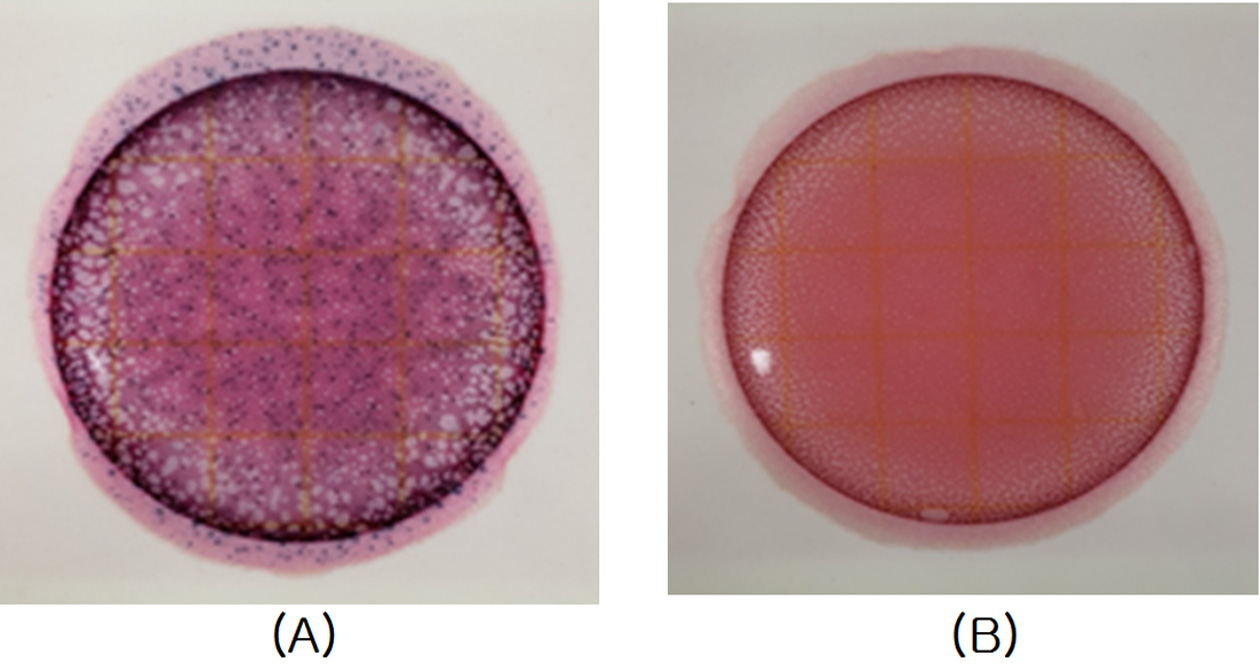
ASTM D3359-02에 근거하여 부착력을 평가한 결과 Fig. 7에서와 같이 코팅 층의 박리현상이 보이지 않아 5B로 평가하였다. 이러한 결과를 바탕으로 코팅막이 안경테 소재 Ultem 기판에 안정적으로 잘 부착되어 부착력이 우수함을 확인할 수 있었다.

Adhesion tests on the different surfaces. (A) control: Uncoated Ultem (B) Antibacterial coated Ultem
3. 코팅막의 항균성 평가
항균 코팅된 안경테 소재인 Ultem 기판의 항균성 시험 결과 그람 음성균인 Escherichia coli(ATCC:10536)에 대하여 대조군 대비 균 감소율이 약 99.9%로 매우 높은 항균력을 확인할 수 있었다.
결 론
본 연구에서는 전구체인 AgNO3와 PVP를 환원제, 분산제, 안정제로 사용하여 Silver nanocolloids를 합성하였다. SEM과 EDS를 통해 은 나노 입자의 형태, 크기, 원소성분을 분석한 결과 약 20~80 nm 크기의 구형, 삼각형, 육각형의 결정을 가지는 Silver nanopartlcles가 형성되어 있었으며, EDS 분석 결과 시료의 구성 물질에는 은이 75.89%, 탄소가 24.11%로 검출되어 Silver nanopartlcles의 합성을 확인할 수 있었다. Escherichia coli에 대한 Silver nanocolloids의 항균 감수성을 알아보기 위해서 Disk diffusion method를 실시한 결과 대조군 대비 Silver nanocolloids의 우수한 항균성을 확인할 수 있었다. 또한 안경테 소재인 Ultem(Polyetherimide: PEI) 기판에 항균 코팅을 한 후 필름 밀착법으로 Escherichia coli에 대한 항균성을 시험한 결과 대조군과 비교하여 약 99.9%의 항균력을 보였다. 코팅막의 특성을 평가하기 위해 AFM 분석 결과 코팅막의 표면 거칠기가 대조군 대비 완만해진 것을 확인 할 수 있었으며, 부착력을 평가한 결과 5B로 박리현상이 보이지 않았다. 본 연구를 통해 합성한 Silver nanopartlcles를 항균물질로 코팅한 안경테 소재인 Ultem 기판의 항균성과 코팅특성이 우수함을 확인할 수 있었다. 이를 바탕으로 Ultem 안경테 소재의 특성을 고려하여 항균 기능성을 갖춘 안경테 제작을 위한 추가적인 연구가 필요할 것으로 사료된다.
References
-
Chen MJ, Chang KJ, Hsu CC, et al. Precaution and prevention of coronavirus disease 2019 infection in the eye. J Chin Med Assoc. 2020;83(7):648-650.
[https://doi.org/10.1097/JCMA.0000000000000334]

-
Bakar NA, Rosbi S. Effect of coronavirus disease(COVID-19) to tourism industry. Int J Adv Eng Res Sci. 2020;7(4):189-193.
[https://doi.org/10.22161/ijaers.74.23]

-
Sun C, Wang Y, Liu G, et al. Role of the Eye in transmitting human coronavirus: what we know and what we do not know. Front Public Health. 2020;8(155):1-7.
[https://doi.org/10.3389/fpubh.2020.00155]

-
Qing H, Li Z, Yang Z, et al. The possibility of COVID-19 transmission from eye to nose. Acta Ophthalmol. 2020;98(3):e388.
[https://doi.org/10.1111/aos.14412]

-
Zeng W, Wang X, Li J, et al. Association of daily wear of eyeglasses with susceptibility to coronavirus disease 2019 infection. JAMA Ophthalmol. 2020;138(11):1196-1199.
[https://doi.org/10.1001/jamaophthalmol.2020.3906]

-
Saxena AK. Risk of corona virus disease 2019(COVID-19) among spectacles wearing population of Northern India. J Clin Diagn Res. 2021;15(5):8-11.
[https://doi.org/10.1101/2021.02.12.21249710]

-
Lehrer S, Rheinstein P. Eyeglasses reduce risk of COVID-19 infection. In Vivo. 2021;35(3):1581-1582.
[https://doi.org/10.21873/invivo.12414]

-
Kim H, Hwang S, Yun CY. The bacterial contamination in glasses for vision correction. J Korean Ophthalmic Opt Soc. 2013;18(1):67-73.
[https://doi.org/10.14479/jkoos.2013.18.1.067]

-
Ahearn DG, May LL, Gabriel MM. Adherence of organisms to silver-coated surfaces. J Ind Microbiol. 1995;15(4):372–376.
[https://doi.org/10.1007/BF01569993]

- Kim JY, Kim T, Yoon J. Antimicrobial activity and mechanism of silver. J Korean Ind Eng Chem. 2009;20(3):251-257.
-
Somlyai-Sipos L, Baumli P, Sycheva A, et al. Development of Ag nanoparticles on the surface of Ti powders by chemical reduction method and investigation of their antibacterial properties. Appl Surf Sci. 2020;533:147494.
[https://doi.org/10.1016/j.apsusc.2020.147494]

-
Villanueva EM, Ghibaudo MF, Tovar GI, et al. Oligomer-stabilized silver nanoparticles for antimicrobial coatings for plastics. Nano-Struct Nano-Objects. 2020;24:100610.
[https://doi.org/10.1016/j.nanoso.2020.100610]

-
Kim JK, Bak SW, Hwang HN, et al. Preparation and properties of silicone-modified epoxy coating materials. Appl Chem Eng. 2014;25(4):352-356.
[https://doi.org/10.14478/ace.2014.1019]

-
Kaewvilai A, Tanathakorn R, Laobuthee A, et al. Electroless copper plating on nano-silver activated glass substrate: a single-step activation. Surface and Coatings Technology. 2017;319:260-266.
[https://doi.org/10.1016/j.surfcoat.2017.04.018]

-
Guo R, Yin G, Sha X, et al. Effect of surface modification on the adhesion enhancement of electrolessly deposited Ag-PTFE antibacterial composite coatings to polymer substrates. Mater Lett. 2015;143:256-260.
[https://doi.org/10.1016/j.matlet.2014.12.125]

-
Skiba M, Vorobyova V, Pivovarov A, et al. Preparation of silver nanoparticles using atmospheric discharge plasma for catalytic reduction of p-nitrophenol: the influence of pressure in the reactor. Pigment Resin Technol. 2020;49(6):449-456.
[https://doi.org/10.1108/PRT-09-2019-0081]

-
Henglein A. Colloidal silver nanoparticles: photochemical preparation and interaction with O2, CCl4, and some metal ions. Chemistry of Materials. 1998;10(1):444-450.
[https://doi.org/10.1021/cm970613j]

-
Patakfalvi R, Virányi Z, Dékány I. Kinetics of silver nanoparticle growth in aqueous polymer solutions. Colloid Polym Sci. 2004;283(3):299-305.
[https://doi.org/10.1007/s00396-004-1138-8]