
황반변성의 예방 및 치료를 위한 송담 추출물의 항산화 효과



초록
항산화능을 가진 소재는 안질환들 중에서 나이연관 황반변성 질환의 예방과 증상 완화 및 치료를 위해 사용되고 있다. 최근에 안구건조, 당뇨, 고혈압, 혈액순환 등에 많은 효능을 보인다고 알려져 있는 송담에 대하여 황반변성의 예방 및 치료 가능성을 보기 위하여 항산화능을 평가하였다.
송담의 항산화 효과를 보기 위하여, 우선적으로 송담의 항산화 활성도를 측정하였다. 여러 농도에서의 세포에 독성을 보이지 않는 최적의 농도를 평가하였고, 여러 항산화 효소들의 활성도를 평가하였다. 또한, 지질과산화물과 활성산소종 농도를 측정함으로써 송담의 효능을 종합적으로 평가하였다.
송담 추출물 농도(10, 50, 100, 500 μg/ml)에서의 항산화 활성도는 농도가 증가함에 따라 항산화 활성도가 통계적으로 유의하게 증가되는 것을 확인하였다. 각 농도에서 세포에 대한 독성을 보기 위하여 세포 생존력을 평가하였고, 항산화 효소(SOD, GSH-Px, CAT)들의 농도를 상대적으로 평가하였다. 이 역시 농도가 증가함에 따라 항산화 효소의 활성이 증가되는 것을 확인하였다. 과산화수소에 의해 증가된 지질과산화물과 활성산소종 농도를 송담 추출물이 통계적으로 유의하게 감소시켰다.
본 연구에서는 송담 추출물이 항산화 효과를 보이는 것을 확인하였고, 이러한 추출물을 이용하여 황반변성을 예방하고 치료 할 수 있는 기능성 소재로 활용 가능 할 수 있음을 시사한다.
Abstract
Antioxidants are frequently involved in the prevention and treatment of eye diseases, including age-related macular degeneration (AMD). Based on several studies, Parthenocissus tricuspidata, a common plant is known for its numerous effects on various diseases such as dry eye disease, diabetes, high blood pressure, and blood circulation.
To examine the antioxidant effect of P. tricuspidata, we first measured its antioxidant activity. Optimal non-toxic concentrations for cellular activity were determined and the activities of various antioxidant enzymes were evaluated. Additionally, the efficacy of P. tricuspidata was comprehensively evaluated by measuring the concentrations of lipid peroxides (MDA) and reactive oxygen species (ROS).
We observed a statistically significant increase in the antioxidant activity with increasing concentrations of P. tricuspidata extract (10, 50, 100, and 500 μg/mL). Cellular viability assessment at each concentration confirmed no cytotoxicity, along with a concentration-dependent increase in the activity of antioxidant enzymes. Notably, the P. tricuspidata extract significantly reduced MDA concentration and ROS levels induced by hydrogen peroxide, which causes cell death.
This study demonstrated that P. tricuspidata extract possesses antioxidant properties, suggesting its potential use as a functional material for preventing and treating eye diseases, including AMD.
Keywords:
Antioxidant, SH-SY5Y, Parthenocissus tricuspidate, Age-related macular degeneration키워드:
항산화, 송담, 황반변성서 론
산화 스트레스(oxidative stress)는 세포와 조직의 반응성 생성물을 해독하는 생물학적 시스템에서 활성산소종(reactive oxygen species, ROS) 발생 및 축적의 불균형으로 인해 발생한다.[1,2] 활성 산소종에는 과산화물 라디칼(superoxide radicals, O2·−), 과산화수소(hydrogen peroxide, H2O2), 하이드록실 라디칼(hydroxyl radical,·OH) 및 일중항산소(singlet oxygen, 1O2)를 포함하고 있다.[3-5]
정상적인 상태에서 세포와 조직내에 존재하는 활성산소종은 단백질 인산화, 여러 전사 인자의 활성화, 세포사멸, 면역 및 분화에 의해 적절하게 생성되거나 낮은 수준으로 유지된다.[5] 활성산소종은 병원균이나 이물질이 인체 내로 침입시 식세포에 의한 식균작용에 의해 발생하고, 이는 우리 몸에서 면역 방어 시스템에 관여하여 항상성을 유지시켜 다양한 질병을 발병하지 않게 하거나 면역을 증진시킨다.[6,7]
그러나 비정상적 상황에서 증가된 활성산소종들이 항산 화제에 의해 충분히 중화되지 않으면 산화 스트레스가 유발하여 세포 내 막지질 과산화, 산화성 DNA 병변, 단백질변형 등 생리학적인 비정상 상태를 유발한다. 이는 여러 생리학적인 효소 불활성화를 유발하고 인체내에서의 여러 질환 발병과 관련이 매우 크다.[8] 결론적으로 비정상적으로 발생된 산화적 스트레스는 인체의 눈, 뇌, 심장, 신장, 피부, 면역기능, 혈관, 폐 등의 세포와 조직에 다양한 질병을 일으킨다.
눈은 여러 외부환경(고압산소, 빛, 자외선, 방사선, 화학물질, 병원 미생물 등)에 대하여 직접적으로 노출되어 있어 비정상적 활성산소종이 발생하는데 매우 취약한 약점을 가지고 있다.[9] 안과 질환에서 산화 스트레스는 여러 질병을 유발하는데 관여하는 것으로 보고되고 있다. 예를 들어, 노화에 따른 황반변성(age related macular degeneration, AMD)[10], 녹내장(glaucoma),[11] 당뇨병성 망막병증(diabetic retinopathy, DR),[12] 망막 정맥 폐색(retinal vein occlusion, RVO)[13] 등이 산화 스트레스와 관련되어 있는 것으로 알려져 있다.[14] 이러한 질병에서 과도하게 생성된 활성산소 종은 망막 색소 상피, 내피세포, 망막 신경절 세포의 생리학적인 부분과 형태학적인 부분에 비정상을 야기한다고 알려져 있다.
최근에 많은 연구에서 눈의 건강과 안질환 치료 및 예방을 위하여 다양한 항산화 물질을 적용하여 세포실험 및 동물실험에서 항산화 물질의 효능을 밝혀내고 기능성 소재, 치료 약물로 서의 가능성을 다양하게 제시하고 있다. 대표적인 항산화 물질로는 비타민 C, 루테인, 제아잔틴, 멜라토닌 등이 있다.[15,16]
송담(Parthenocissus tricuspidata)은 포도과에 속하는 낙엽 덩굴식물로, 아시아 및 유럽에 주로 분포하고 있다. 송담은 phenolic acid, flavonoid, anthocyanin, hydroxybenzoic acid 등 다양한 기능성 성분을 함유하고 있다. 기존 연구들에서 비만, 당뇨, 관절염 등에서 다양한 효능을 보이는 것으로 알려져 있다.[17-19]
본 연구에서는 송담 추출물에 대하여 총 항산화 활성도를 측정하고 과산화수소에 의해 유도된 독성으로 감소되는 항산화 효소 활성도(SOD, GSH-Px, CAT), MDA, ROS를 평가하여 안질환인 황반변성, 녹내장, 당뇨병성 망막병증 등에 대한 질병의 억제 및 치료 천연물 소재로 가능성을 보고자 한다.
대상 및 방법
1. 송담 추출 및 약물 처리
10 kg의 송담을 100 리터의 용매에 넣고 8 시간 동안 80°C로 가열하고, 여과지에 걸러 갈색의 액체를 얻었다. 이를 수 회 반복하여 송담 추출액을 수득하였고, 얻어진 추출액은 동결건조를 통해 분말형태의 송담 추출물을 제조하였다. 신경세포인 SH-SY5Y 세포주는 American type culture collection(Manassas, VA, USA)에서 구매하였으며, 세포 배양을 위해 기존에 기술된 방법에 따라 세포를 배양하였다. 송담 추출물을10, 50, 100, 500 μg/ml 농도에서 SH-SY5Y 세포에 처리하였다. 세포 생존율 및 항산화 효소의 활성을 보기 위하여 여러 농도의 송담 추출물을 세포에 처리하였고, 동시에 과산화수소(hydrogen peroxide, H2O2) 100 μM을 처리하여 세포 독성을 일으켜 송담 추출물의 효능을 평가하였다.
2 세포 생존율 평가
세포 생존력은 3-(4,5-디메틸티아졸-2-일)-2,5-디페닐 테트라졸륨 브로마이드 (MTT) 분석에 의해 평가하였다. 생존력을 평가하기 위하여 세포를 96 well plate에서 24시간 동안 배양하였고, 배양 배지를 제거하고 무혈청 배지로 교체하였다. 세포를 1시간 동안 송담 추출물(10, 50, 100 및 500 μg/ml)로 전 처리한 다음 24시간 동안 과산화수소 100 μM 농도에 노출시켰다. 배지를 교체하고 각 well에 MTT(최종농도: 0.5 mg/ml)를 첨가한 후 세포를 37°C, 암실에서 4시간 동안 배양하였다. 그 후, 형성된 불용성 포르마잔 결정을 100 μl의 dimethyl sulfoxide(DMSO)로 용해 시켰다. 흡광도는 Soft max pro 소프트웨어가 장착된 마이크로플레이트 리더(E-max; Molecular devices, Sunnyvale, CA, USA)를 사용하여 540 nm에서 측정하여 세포 생존율을 평가하였다.
3. ABTS 라디칼을 이용한 총 항산화능 측정
송담 추출물의 항산화 활성은 ABTS(2,2’-azino-di-[3-ethylbenzthiazoline sulphonate]) 라디칼이 적용된Antioxidant assay kit를 이용하여 제조사의 메뉴얼에 따라 측정하였다. 이 방법은 metmyoglobin에 의해 ABTS가 ABTS·+로 산화되는 것을 억제하는 시료 내 항산화제의 능력을 분석하는 것이다. 측정 샘플을 준비하기 위해 SH-SY5Y 세포에 송담 추출물과 과산화수소100 μM을 처리하여 24시간 동안 배양한 후에 세포 용해물을 획득하였다. 96 well plate에 샘플 10 μl, metmyoglobin 10 μl, chromogen 150 μl, hydrogen peroxide working solution 40 μl를 첨가하여 실온에서 5분간 반응시킨 후 750 nm에서 흡광도를 측정하였다.
4. 항산화 효소 활성도 측정(SOD, CAT, GSH-Px)
SH-SY5Y 세포를 6 well plate에 배양하고 세포 생존율을 평가하기 위한 동일 조건으로 송담 추출물을 처리하였다. 세포를 수집하고 12,000 rpm에서 10분간 원심 분리 후 모아진 세포를 RIPA 완충액으로 용해하였다. 4°C에서 12,000 rpm, 20분간 원심분리한 후 상층액을 제조사의 메뉴얼에 따라 superoxide dismutase(SOD), catalase(CAT), glutathione peroxidase(GSH-Px) 활성 분석을 측정하였다. SOD 활성은 450 nm, CAT 활성은 570 nm, GSH-Px 활성은 340 nm에서 측정되었다. SOD, CAT 및 GSH-Px의 활성은 대조군 대비 %로 표시하였다.
5. 지질과산화물의 측정(MDA)
지질 과산화물은 세포 배양에서 티오바르비투르산 물질(TBARS)을 이용하여 측정되었다. 용해물(100 μL)과 MDA 표준 물질을 1.5 ml 튜브에 섞은 후 10분 동안 배양하였다. 1,600 g에서 10분간 원심분리한 후 상층액의 흡광도를 535 nm에서 측정하였고, MDA 수준은 %로 표시되었다.
6. 활성산소종 측정(ROS)
세포 내 ROS 생산은 형광 프로브인 2',7'-디클로로플루오레세인 디아세테이트(DCFH-DA; Sigma-Aldrich)를 사용하여 측정하였다. 세포를 형광 마이크로타이터 microtiter black-walled 96-well plates(5 × 104 세포/well)에 넣고 송담 추출물을 1시간 동안 처리하였다. 20 μM DCFH-DA를 각 well에 첨가하고 37°C에서 30분간 배양하였다. 인산염 완충 식염수(PBS)로 세척한 후, 각 well에 100 uM H2O2를 첨가하였다. ROS에 의한 DCFH의 산화로 인한 형광 디클로로플루오레세인(DCF)의 형성은 마이크로플레이트 리더를 사용하여 여기 파장 480 nm 및 방출 파장 520 nm에서 10분마다 평가되었다.
7. 통계분석
모든 실험 결과는 평균 ± S.E.M으로 표시되었다. 통계적 유의성은 일원 분산 분석(ANOVA)와 Tukey 테스트를 통해 통계적 유의성을 평가하였다. IBM SPSS Statistics 23 소프트웨어에서 유의미한 차이가 계산되었으며, 0.05 미만의 P 값은 유의미한 것으로 간주하였다.
결과 및 고찰
1. 세포 생존률 평가
Fig. 1에서는 세포의 생존력을 평가한 결과를 보여주고 있다.
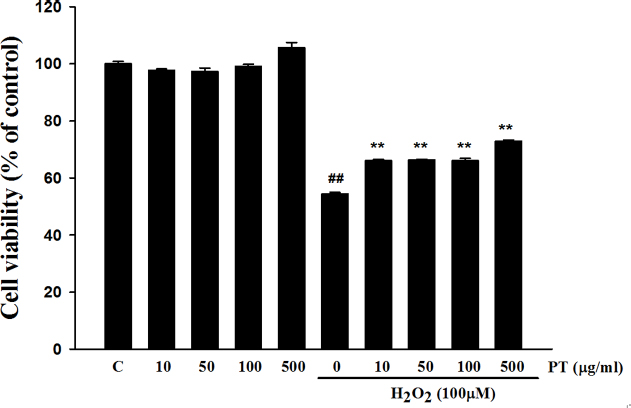
Cell viability. Cell viability evaluation of Parthenocissus tricuspidata extract on H2O2-induced cell death in SH-SY5Y cells using MTT. Values were shown as mean ± S.E.M. ##p<0.01 compared with control. **p<0.01 compared with H2O2 treated cells.
송담의 농도를 10, 50, 100, 500 μg/ml으로 다양하게 처치한 결과, 세포의 사멸에 영향을 미치지 못하는 것을 확인하였다. 과산화수소 100 μM 농도로 세포에 처리한 경우에는 대조군에 비하여 세포가 약 50% 정도 세포 사멸이 일어나는 것을 확인하였다. 과산화수소 100 μM 농도와 송담을 여러 농도로 처치하고 MTT assay로 세포 생존력을 평가한 결과, 송담에 의해 세포 사멸이 통계적으로 유의하게 억제됨을 확인하였다. 이는 송담이 세포 사멸을 억제하는 것을 의미한다.
2. 항산화 활성도 측정
Fig. 2에서는 송담의 총 항산화 활성도 결과를 보여주고 있다.
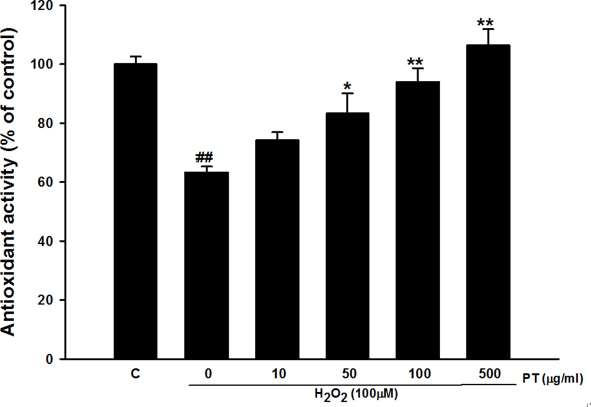
Antioxidant activity of Parthenocissus tricuspidata extract. Values were shown as mean±S.E.M. ##p<0.01 compared with control. *p<0.05 and **p<0.01 compared with H2O2 treated cells.
ABTS 라디칼을 이용한 항산화능을 측정한 결과, 과산화수소 100 μM에 의해 항산화능이 유의하게 감소하는 것을 확인하였다. 송담의 농도를 10, 50, 100, 500 μg/ml으로 다양하게 처치한 결과, 송담의 농도가 증가함에 따라서 총항산화 활성도가 통계적으로 유의하게 증가하는 것을 확인하였다. 이는 송담이 세포 사멸억제에 대하여 항산화 활성도 증가와 관련 있음을 의미한다.
3. 항산화 효소 활성도 측정(SOD, CAT, GSH-Px)
Fig. 3에서는 항산화 효소인 SOD, CAT, GSH-Px들의 활성도를 송담의 다양한 농도에서 결과를 보여주고 있다.
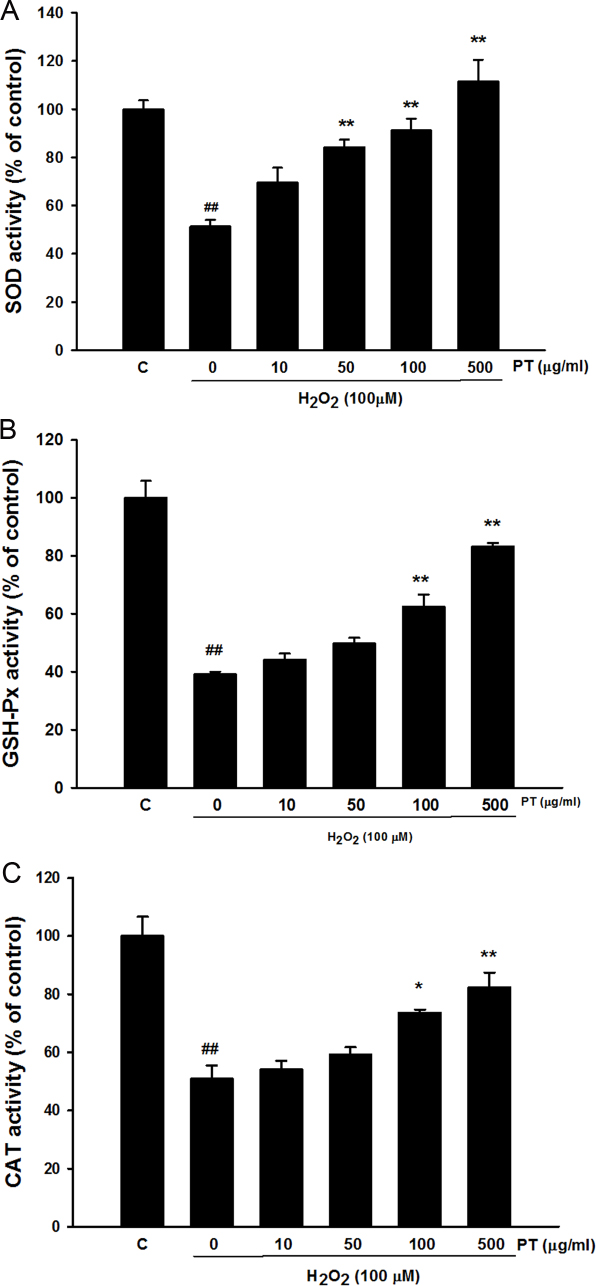
Effect of Parthenocissus tricuspidata extract on antioxidant enzyme activity. A. The SOD activity, B. The GSH-Px activity, C. The CAT activity Values were presented as mean ± S.E.M. ##p<0.01 compared with control. *p<0.05 and **p<0.01 compared with H2O2 treated cells.
대조군에 비하여 SOD의 활성도는 과산화수소만을 처치한 그룹에서 약50% 정도 감소되는 것을 확인하였다. 그리고 송담의 농도가 증가함에 따라 SOD 활성도가 농도 의존적으로 유의하게 증가되는 것을 확인하였다. 송담의 500 μg/ml 농도에서 SOD 활성도는 대조군과 비슷한 수준으로 회복되었다(Fig. 3A). 대조군에 비하여 GSH-Px의 활성도는 과산화수소만을 처치한 그룹에서 약40% 정도로 감소되는 것을 확인하였으며, 송담 추출물 처리에 의해 이러한 GSH-Px활성 감소가 유의하게 억제되는 것을 확인하였다(Fig. 3B). 송담의 500 μg/ml 농도에서 대조군의80% 정도 수준으로 증가하였다. 대조군에 비하여 CAT의 활성도는 과산화수소만을 처치한 그룹에서 약50% 정도 감소되는 것을 확인하였다. 송담 추출물 처리시 100 μg/ml 이상의 농도에서 유의하게 CAT 활성도가 개선되는 것을 확인하였다. 송담의 500 μg/ml 농도에서 대조군의 80% 정도 수준으로 증가하였다(Fig. 3C).
4. 지질과산화물의 측정(MDA)
Fig. 4에서는 지질과산화물을 측정한 결과를 보여주고 있다.
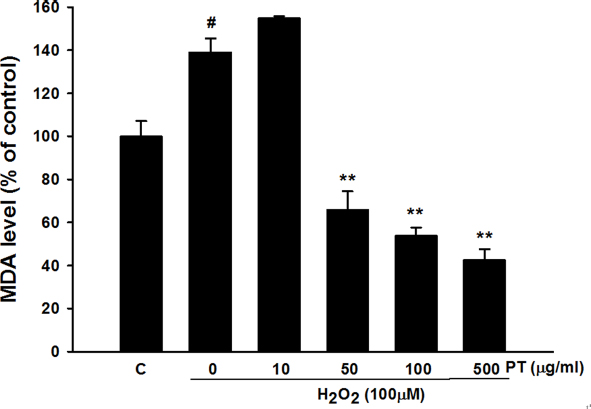
Effect of Parthenocissus tricuspidata extract on MDA level. Values were presented as mean± S.E.M. #p<0.05 compared with control. **p<0.01 compared with H2O2 treated cells.
대조군에 비해서 과산화수소 100 μM 농도로 처치한 세포에서는 지질과산화물의 수준이 약 40% 정도 증가한 것을 확인하였다. 증가된 지질과산화물은 10 μg/ml 송담 추출물의 농도에서는 증가된 지질과산화물을 감소시키지는 못하였고, 50, 100, 500 μg/ml 송담 추출물의 농도에서 농도가 증가함에 따라 지질과산화물의 농도를 통계적으로 유의하게 감소시키는 것을 확인하였다.
5. 활성산소종 측정(ROS)
Fig. 5에서는 활성산소종을 측정한 결과를 보여주고 있다.
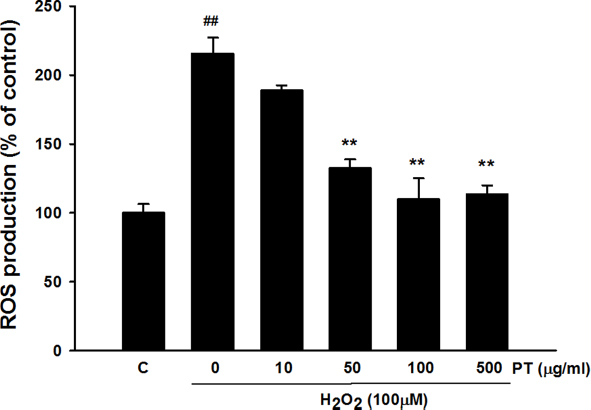
Effect of Parthenocissus tricuspidata extract on ROS production. Values were presented as mean±S.E.M. ##p<0.01 compared with control. **p<0.01 compared with H2O2 treated cells.
대조군에 비해서 과산화수소 100 μM 농도로 처치한 세포에서는 활성산소종이 약 2.2배 증가된 것을 확인하였다. 증가된 활성산소종은 10 μg/ml 송담 추출물의 농도에서 약간의 감소를 보였지만 통계적으로는 유의하지 않았다. 50, 100, 500 μg/ml 송담 추출물의 농도에서는 농도가 증가함에 따라 활성 산소종의 농도를 통계적으로 유의하게 감소시키는 것을 확인하였다.
최근, 국민건강영양 조사에 따르면 연령관련 황반변성의 유병률은 13.4%, 당뇨망막병증은 19.6%, 녹내장은 3.4%이며 각 안질환에 대한 유병률이 매년 꾸준히 증가하고 있다. 특히, 황반변성은 2008년 11.8%에서 2018년에는 13.4%으로 증가하였다. 황반변성은 눈의 황반 부위에 변화와 손상이 생기는 안과 질환에 속하며, 노화와 매우 관련된 안질환 중 하나이다.[20] 황반변성은 현재까지 완전한 치료가 없는 만성 안질환에 속한다. 황반변성의 치료는 황반변성의 종류, 진행정도에 따라 달리 치료 전략을 달리 하고 있다. 예를 들어, 정기적인 안과 검진을 통해 황반의 변화를 모니터링, 개인의 생활습관 개선, 유리체 절제술 등을 통해 치료를 시행하고 있다. 따라서, 황반변성에 대한 조기 진단 및 황반변성의 발병 억제를 위한 안건강의 증진이 매우 중요하다고 할 수 있다.
최근에 황반변성 발병을 예방하기 위하여 많은 연구들에서 항산화능을 가진 영양소와 식품이 황반변성 발병을 억제하고 증상을 관리하는데 도움을 줄 수 있다고 보고 되어지고 있다.[21,22] 황반변성에 대한 예방 및 치료를 위해 효능이 밝혀진 항산화 소재로는 루테인, 제아잔틴, 비타민C, E, 아연, 오메가-3-지방산, 아스타잔틴이 등이 있다. 본 연구에서는 다양한 안질환에서, 특히 황반변성에 대한 예방 및 치료를 위해 항산화 소재로서 가능성을 살펴보기 위하여 송담의 항산화 효능을 평가하였다. 기존 연구에서 송담이 안구 건조 질환에 대한 항산화 및 항염 효과를 나타낸다는 것을 보고 하였고 이는 본 연구 결과와 유사하였다.[23]
결 론
항산화 기능을 가진 소재는 안질환 중에서 황반변성 질환을 예방 및 치료하는데 도움을 줄 수 있는 소재이다. 본 연구에서는 송담의 항산화 효과를 통해 황반변성 질환을 예방하고 치료하는 기능성 소재로써 활용가능한지를 평가하였다. 송담 추출물 총 항산화력에 있어서 500 μg/ml 에서 가장 많이 증가시키는 것을 확인하였다. 송담 추출물의 500 μg/ml 내에서는 세포 독성을 나타내지 않았으며 세포사멸 억제를 통해 세포의 보호 효과를 보였다. 송담 추출물의 세포 사멸에 대한 보호 기전을 알아보기 위하여 항산화 효소(SOD, GSH-Px, CAT)들의 활성을 측정한 결과 이러한 효소들이 증가함을 확인하였다. 또한, 증가된 지질과 산화물, 활성산소종이 송담에 의해 감소되는 것을 확인하였다. 이를 통해 송담은 세포 사멸에 대하여 항산화 효소들의 증가와 지질과산화물과 활성산소종을 감소시킴으로써 세포 보호를 하는 것을 의미한다. 이는 송담이 황반변성 질환에 대한 기능성 소재로써 가능성이 있음을 시사한다. 하지만 이러한 송담의 항산화 효능이 황반변성 질환에 직접적으로 질환의 억제 및 치료를 보이는지에 대한 추가적인 연구가 필요하다.
References
-
Jomova K, Raptova R, Alomar SY, et al. Reactive oxygen species, toxicity, oxidative stress, and antioxidants: chronic diseases and aging. Arch Toxicol. 2023;97:2499-2574.
[https://doi.org/10.1007/s00204-023-03562-9]

-
Kumar H, Dhalaria R, Guleria S, et al. Anti-oxidant potential of plants and probiotic spp. in alleviating oxidative stress induced by H2O2. Biomed Pharmacother. 2023;165:115022.
[https://doi.org/10.1016/j.biopha.2023.115022]

- Hollan S. Free radicals in health and disease. Haematologia( Budap). 1995;26(4):177-189.
-
Halliwell B, Cross CE. Oxygen-derived species: their relation to human disease and environmental stress. Environ Health Perspect. 1994;102(10):5-12.
[https://doi.org/10.1289/ehp.94102s105]

-
Riley PA. Free radicals in biology: oxidative stress and the effects of ionizing radiation. Int J Radiat Biol. 1994;65(1):27-33.
[https://doi.org/10.1080/09553009414550041]

-
Richter C, Gogvadze V, Laffranchi R, et al. Oxidants in mitochondria: from physiology to diseases. Biochim Biophys Acta. 1995;1271(1):67-74.
[https://doi.org/10.1016/0925-4439(95)00012-s]

-
Buttke TM, Sandstrom PA. Redox regulation of programmed cell death in lymphocytes. Free Radic Res. 1995;22(5):389-397.
[https://doi.org/10.3109/10715769509147548]

-
Chaudhary MR, Chaudhary S, Sharma Y, et al. Aging, oxidative stress and degenerative diseases: mechanisms, complications and emerging therapeutic strategies. Biogerontology. 2023;24:609-662.
[https://doi.org/10.1007/s10522-023-10050-1]

-
Masuda T, Shimazawa M, Hara H. Retinal diseases associated with oxidative stress and the effects of a free radical scavenger(Edaravone). Oxidative Medicine and Cellular Longevity. 2017;2017:9208489.
[https://doi.org/10.1155/2017/9208489]

-
Kaarniranta K, Uusitalo H, Blasiak J, et al. Mechanisms of mitochondrial dysfunction and their impact on age-related macular degeneration. Prog Retin Eye Res. 2020;79:100858.
[https://doi.org/10.1016/j.preteyeres.2020.100858]

-
Dammak A, Huete-Toral F, Carpena-Torres C, et al. From oxidative stress to inflammation in the posterior ocular diseases: diagnosis and treatment. Pharmaceutics. 2021;13(9):1376.
[https://doi.org/10.3390/pharmaceutics13091376]

-
Nebbioso M, Franzone F, Lambiase A, et al. Oxidative stress implication in retinal diseases-a review. Antioxidants. 2022;11(9):1790.
[https://doi.org/10.3390/antiox11091790]

-
Chan TCW, Wilkinson Berka JL, Deliyanti D, et al. The role of reactive oxygen species in the pathogenesis and treatment of retinal diseases. Exp Eye Res. 2020;201:108255.
[https://doi.org/10.1016/j.exer.2020.108255]

-
Lin JB, Murakami Y, Miller JW, et al. Neuroprotection for age-related macular degeneration. Ophthalmol Sci. 2022;2(4):100192.
[https://doi.org/10.1016/j.xops.2022.100192]

-
Mehrzadi S, Hemati K, Reiter RJ, et al. Mitochondrial dysfunction in age-related macular degeneration: melatonin as a potential treatment. Expert Opin Ther Targets. 2020;24(4):359-378.
[https://doi.org/10.1080/14728222.2020.1737015]

-
Sacca SC, Cutolo CA, Ferrari D, et al. The eye, oxidative damage and polyunsaturated fatty acids. Nutrients. 2018;10(6):668.
[https://doi.org/10.3390/nu10060668]

-
Lee SH, Liu Q, Hwang BY, et al. Inhibitory effects of stilbene derivatives from Parthenocissus tricuspidata on adipocyte differentiation and pancreatic lipase. Nat Prod Commun. 2013;8(10):1439-1441.
[https://doi.org/10.1177/1934578X1300801026]

-
Son IH, Chung IM, Lee SJ, et al. Antiplasmodial activity of novel stilbene derivatives isolated from Parthenocissus tricuspidata from South Korea. Parasitol Res. 2007;101(1):237-241.
[https://doi.org/10.1007/s00436-006-0454-y]

-
Kim HJ, Saleem M, Seo SH, et al. Two new antioxidant stilbene dimers, parthenostilbenins A and B from Parthenocissus tricuspidata. Planta Med. 2005;71(10):973-976.
[https://doi.org/10.1055/s-2005-871229]

-
Thomas CJ, Mirza RG, Gill MK. Age-related macular degeneration. Med Clin North Am. 2021;105(3):473-491.
[https://doi.org/10.1016/j.mcna.2021.01.003]

-
Garcia-Layana A, Cabrera-Lopez F, Garcia-Arumi J, et al. Early and intermediate age-related macular degeneration: update and clinical review. Clin Interv Aging. 2017;12:1579-1587.
[https://doi.org/10.2147/CIA.S142685]

-
Evans JR, Lawrenson JG. Antioxidant vitamin and mineral supplements for slowing the progression of age-related macular degeneration. Cochrane Database Syst Rev. 2017;7(7):CD000254.
[https://doi.org/10.1002/14651858.CD000254.pub4]

- Cho KJ, Kim J, Kim ZU. Effect of parthenocissus tricuspidata extract living on pine in pre-clinical model of dry eye disease. Invest Ophthalmol Vis Sci. 2019;60(9):264.