스마트기기 빛 조사로 유도되는 A2E의 광산화에 의한 망막색소상피세포의 사멸

초록
본 연구는 나이관련 황반변성(Age-related macular degenaration)의 원인으로 알려진 A2E가 축적된 망막색소상피세포에서 스마트기기에서 발생하는 빛 조사 의한세포사멸을 확인하였다.
두 분자의 all-trans-retinal과 한 분자의 ethanolamine을 합성하여 만든 A2E를 망막색소상피세포(ARPE-19)에 축적하여 광산시켰다. 이를 세포에 광산화를 유도히기위해 스마트기기의 빛을 조사하여였다. A2E의 농도와 스마트기기에서 발생하는 빛 조사시간을 다르게 하여 세포 사멸을 확인하였다. 스마트기기에서 발생하는 빛 조사로 유도되는 망막색소상피세포의 생존도를 MTT assay와 면역형광검사(DAPI staining)을 통해 확인하였다.
A2E가 축적된 망막색소상피세포의 스마트 기기 빛 조사에 의한 세포 사멸은 빛 조사 시간과 A2E의 축적 농도에 따라 다르게 나타났으며, 스마트 기기 빛 조사를 통해 A2E 축적 농도가 2.5 μM일 때 통계적으로 유의한 결과가 보이지 않았다. 5 μM 이상에서는 유의미한 세포 사멸이 관찰되었으며, 특히 40 μM에서는 90% 가까운 세포 사멸을 보였다. 빛 조사시간이 1.5시간부터 유의미한 세포 사멸이 관찰되었으며, 6시간은 50%이상, 12시간은 90%이상 세포 사멸을 보였다.
본 연구 결과를 통하여 스마트 기기 빛 조사 시간에 따라 나이관련황반변성의 원인 물질인 A2E를 축적시킨 망막색소상피세포는 A2E 축적농도가 높고, 스마트기기의 빛 노출 시간이 길수록 세포 사멸이 증가되는 것으로 확인하였다.
Abstract
In this study, we investigated the death of A2E-loaded retinal pigment epithelial cells at different concentrations and smart device light irradiation time of A2E, known as the cause of age-related macular degeneration.
A2E, a synthetic product of two all-trans-retinal molecules and one ethanolamine, was accumulated in retinal pigment epithelial cells (ARPE-19). The cells were exposed to smart device light to induce photooxidation. Cell death was confirmed after light irradiation at different concentrations of A2E and different light irradiation times. The cell viability induced by the smart device light irradiation was confirmed by MTT assay and immunofluorescence (DAPI staining).
When smart device light irradiated the ARPE-19 cells, cell death was resulted differently according to the A2E concentration and light irradiation time. There was no statistically significant result when the A2E concentration was 2.5 μM. Significant apoptosis was observed at concentrations above 5 μM, whereas 90% apoptosis was observed at 40 μM. Significant cell death was observed after 1.5 h of light irradiation. More than 50% of cells died at 6 h whereas more than 90% at 12 h.
In this study, A2E-loaded retinal pigment epithelial cell death was confirmed according to the light irradiation time of the smart device and the concentration of A2E.
Keywords:
Age-related macular degeneration, Retinal pigment epithelium cell, A2E, Smart device, Apoptosis키워드:
나이 관련 황반변성, 망막색소상피세포, A2E, 스마트기기, 세포사멸서 론
망막은 1백 마이크로미터 두께의 민감하고 투명한 막으로 색소상피층과 신경상피층으로 구분된다. 신경상피층은 두 개의 시냅스 층으로 분리된 세 개의 세포층으로 배열되고, 원뿔세포, 막대세포, 수평세포, 양극세포, 무축삭세포, 그리고 뮬러세포로 구성되어 있다. 망막색소상피세포(retinal pigment epithelium)는 혈액 망막 장벽을 형성하여 물질의 선택적인 수송에 역할을 한다. 또한 광수용세포에 영양을 공급하고 이온 항상성을 조절하며 물과 대사산물을 제거하는 역할을 한다.[1]
광수용세포에 영양 공급 및 물질 전달 역할을 하는 망막 최외층인 망막색소상피세포가 기능을 못하게 되면 광수용세포에 영양 공급 및 항상성에 영향을 미치고 이는 결국 실명에 이르게 된다. 이러한 망막색소상피의 기능이상으로 발생하는 대표적인 질병이 나이 관련 황반변성이다(Age-related macular degeneration). 나이 관련 황반변성은 50세 이상에서 발생하는 양안성 질환으로 노년기 시력상실의 주원인 중 하나로 황반의 기능을 저하시켜 사물이 왜곡되어 보이고, 중심시력이 저하되거나 상실되는 질병이다. 습성(exudative, wet type)과 건성(non-exudative, dry type)으로 나나뉘는 황반변성은 질병의 90%가 건성 황반변성이며 이는 시간이 지남에 따라 습성으로 진행하게 되며 이러한 결과로 인해 눈은 실명에 이르게 된다.[2]
A2E(N-retinylidene-N-retinyl-ethanolamine)는 망막색소상피세포 핵 주변의 리소좀에 축적되는 비타민 A의 유도체로 시각 활동 중에 발생하는 all-trans-retinal과 ethanolamine이 2:1로 결합한 형태로, 광수용세포에서 만들어져 망막색소상피세포에 축적되는 형광색소물질이다. 축적된 A2E는 청색광에 의해 과산화물(superoxide)인 oxy-A2E로 변형되고, 일중항 산소(singlet oxygen)를 발생시킨다. 광산화로 인해 만들어진 oxy-A2E는 망막색소상피세포 내에서 자기세포사멸(apoptosis)를 일으켜 망막신경층에 영양을 공급하지 못하게 되며, 광수용체 세포의 사멸을 일으켜 나이 관련 황반변성을 유발시키는 형광색소물질이다.[3-5]
스마트폰과 태블릿으로 대표되는 스마트기기는 대부분 LED(light emitting diode) 패널을 사용하고 있다. 이러한 LED 패널은 자연광에 비해 청색광을 많이 함유하고 있다. Moon 등[6] 의 연구에 따르면 LED 패널 개발자들은 청색광의 파장의 위치를 변형시키는 연구를 진행하고 있지만 현재 사용되는 대부분의 LED 패널들은 망막 기능 저하에 영향을 미치는 패널이 사용되고 있다. 최근 보고에 따르면 한국인의 91.1%가 스마트기기를 보유하고 있으며 평균 3시간 이상의 사용시간을 보인다고 하였다. 이러한 이유로 현대인은 청색광의 노출 빈도가 과거보다 높아졌다. 최근 보고에서는 청색광에 의해 산화가 일어나는 형광색소물질 A2E가 스마트폰의 빛 노출로 인해 36.75% 산화되는 것을 확인하였다.[7]
나이 관련 황반변성에 대한 정확한 병인은 아직 밝혀지지 않았으며 특별히 개발된 치료법이나 약물이 없고 예방이 최우선으로 생각되고 있다. 본 연구에서는 나이 관련 황반변성의 원인으로 알려진 망막색소형광물질인 A2E를 망막색소상피세포에 축적시켜 빛 조사에 의해 A2E가 축적된 망막색소상피세포가 사멸하는지를 확인하고, 축적 농도와 스마트기기 빛 조사 시간을 달리하였을 때 사멸되는 정도의 변화를 확인하고자 하였다.
재료 및 방법
1. 재료
본 실험은 망막색소상피세포(ARPE-19, CRL-2302, ATCC, USA)를 사용하였고 A2E 합성에는 all-trans-retinal, ethanolamine, acetic acid, trifluoroacetic acid(TFA), ethanol(Sigma-Aldrich Co. USA)를 사용하였다. 세포 배양은 Dulbecco’s Modified Eagle Medium(DMEM), bovine fatal serum(FBS), streptomycin/penicillin(Welgene Inc., Korea)을 사용하였다.
2. A2E 합성과 정제
시각 활동의 부산물인 A2E의 합성은 기존 문헌에 의한 A2E의 합성은 all-trans-retinal(30.00 mg, 105.60 μM), ethanolamine(2.85 mg, 46.50 μM)과, acetic acid(2.79 μL, 46.50 μM)를 첨가한 ethanol(3.00 mL)에 녹여 상온의 암실에서 3일 동안 교반하였다.[8] 합성 후 진공으로 농축한 다음 MPLC(middle pressure liquid chromatography, Combiflash Retrieve, USA)를 이용하여 정제하였다.[9] 정제된 A2E는 HPLC 분석을 통해 A2E의 순도 95%이상을 확인하고 dimethyl sulfoxide(DMSO)로 20.00 mM용액을 만들어 –20°C에 보관하였다.
3. 세포배양
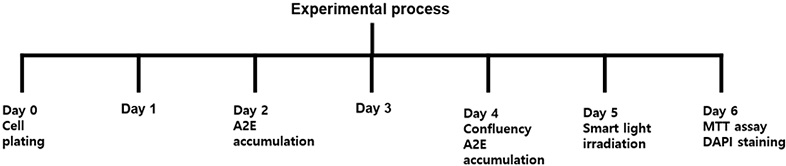
망막색소상피세포는 high-glucose DMEM에 10% FBS와 streptomycin/penicillin을 첨가한 배지를 사용하여 37oC의 5% CO2 배양기(MCO-20AIC, Sanyo, Japan)에서 배양하였다. 세포는 24 well plate(SPL, Korea)에 분주하여 배양하였고 A2E는 망막색소상피세포 분주 후 2일 간격으로 2회 축적하고 활성실험을 실시하였다(Fig. 1).
4. 스마트기기 빛 조사
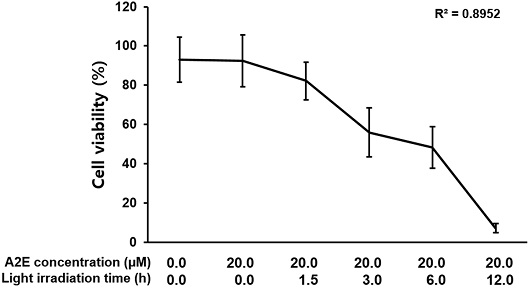
A2E가 축적된 망막색소상피세포에 스마트기기 빛을 조사하였다. 스마트기기 빛 조사는 크기 11 inch, 밝기는 600 cd/m2, 해상도 264 ppi인 태블릿(iPad, Apple Inc., USA)을 사용하였다. 빛 조사를 하기 전 배양된 세포의 붉은색 배양액이 스마트기기에서 발생하는 백색광을 차단할 가능성이 있어서 phenol red 시약이 첨가되지 않은 DMEM(Welgene Inc., Korea)으로 배양액을 교환였다. 실험은 A2E 축적농도별(2.5 μM, 5.0 μM, 10.0 μM, 20.0 μM, 40.0 μM)로 3시간 조사한 경우와 A2E 20.0 μM 축적된 망막색소상피세포에 빛 조사시간을 달리하여(1.5 h, 3.0 h, 6.0 h, 12.0 h) 세포생존율을 확인하였다(Fig. 2).
5. MTT assay
스마트기기 빛 조사에 의한 세포사멸 정도를 알아보기 위해 MTT assay를 사용하였다. 스마트기기 빛 조사 후 21시간 배양한 ekamd 10% MTT(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide)를 첨가하여 MTT가 환원되도록 3시간 동안 추가 배양하였다. 배양이 끝난 후 각 격자에 생성된 formazan 결정만 남기고 상등액을 제거 한다음, DMSO 용액으로 희석하고 Microplate Spectrophotometer(Epoch, Bio-Tek, USA)를 이용하여 540 nm에서 흡광도를 측정하였다. 빈 격자의 흡광도를 기준으로 A2E 축적 군과 빛조사 군의 상대적인 세포 생존율을 계산하였다.
6. DAPI staining
망막색소상피세포에 A2E가 축적된 정도와 스마트기기 빛 조사 시간에 의한 세포사멸 정도를 알아보기 위해 DAPI 염색을 실시하였다. 망막색소상피세포를 챔버 슬라이드에 분주하고 A2E를 2회 축적하였다. 스마트기기 빛 조사 후 3시간 배양하여 인산완충액을 이용하여 세척하였다. 세척한 세포는 100% 메탄올로 고정 시킨 후 2.5 μg/mL 4',6'-diamidino-2-phenylindole(DAPI, Sigma-Aldrich Chemical Co., USA) 용액을 처리하여 암실에서 20분 동안 반응시키고 1x 인산완충액으로 3회 세척한 다음 형광현미경(Carl Zeiss, Oberkochen, Germany)으로 관찰하였다.
7. 통계처리
망막색소상피세포에 A2E를 축적 시킨 후 스마트기기 빛을 조사하여 A2E의 농도와 빛 조사시간에 따른 세포 생존율을 측정하였다. 각 실험의 결과값에 대하여 one-way ANOVA(Prism, Graphad software, USA)를 실시하였다. 신뢰도 95%를 기준으로 하여, 유의수준(p-value)이 0.05 이하이면 유의한 차이가 있는 것으로 판단하였다.
결과 및 고찰
시각 활동의 부산물로 발생하는 A2E는 청색광에 의해 광산화가 일어난다. A2E가 축적된 망막색소상피세포에서 청색광에 의해 세포사멸이 유발되는 것은 기존 연구를 통해 충분히 알려진 사실이다.[3] 또한, A2E는 청색광뿐만 아니라 스마트기기의 빛에 의해서도 산화가 일어나는 것으로 통해 알려져 있다.[7] 본 연구에서는 A2E가 망막색소상피세포(ARPE-19 cells)에 축적되는 형태를 확인하고 스마트기기에서 발생하는 빛이 A2E가 축적된 ARPE-19세포에서 광산화에 의한 세포사멸을 유도하는지 확인하였다. DAPI 염색을 통해 농도별로 A2E가 축적되는 정도를 확인한 결과 2.5 μM에서는 ARPE-19세포에 축적되는 것을 확인할 수 없었다. 하지만 5.0 μM 이상의 농도에서는 ARPE-19세포의 핵 주변 세포 원형질 부분에 A2E의 축적이 일어나는 것을 확인할 수 있었고, 농도가 증가함에 따라 A2E의 축적이 증가되는 것을 알 수 있었다(Fig. 3-A). 기존 연구에 의하면 A2E는 ARPE-19 세포 원형질에 축적된 A2E는 리소좀 저장체 내에 축적되는 것으로 알려져 있다.[8] A2E가 축적된 ARPE-19 세포에 스마트기기 빛 조사 후 세포 변화 양상을 확인하기 위해 DAPI 염색을 실시하였다. A2E는 청색광이나 스마트기기에 의해 광산화가 발생을 하면 형광 파장이 변화하여 형광 발색을 잃게 되는데, 실험 결과 빛 조사 후 핵의 개수와 핵의 형태 변화가 관찰되어 ARPE-19 세포의 사멸이 발생한 것을 알 수 있었다(Fig. 3-B). Fig. 3-B에서와 같이A2E의 색상이 밝아진 것처럼 보이는 것은 ARPE-19 세포가 광산화에 의해 세포 위축이 일어나 핵 주변으로 원형질이 응축되었다는 것을 보여주는 것이다. 그리고 전반적인 배양상태를 보더라도 스마트기기 빛에 의해 A2E 산화가 발생한 차이를 뚜렷이 구분할 수 있다.

Micrographs of A2E-loaded ARPE-19 cells stained with DAPI in with (A) or without (B) smart device light.
3시간 동안 스마트기기의 빛을 조사한 결과 세포 생존율은 2.5 μM 에서는 88.50±7.95%, 5.0 μM에서는 70.07±9.36%, 10.0 μM에서는 60.16±13.14%, 20.0 μM에서는 56.90±5.79%, 40.0 μM에서는 12.48±2.65%였다. 이 생존율을 A2E가 축적된 세포에 빛 조사를 하지 않은 경우의 생존율을 기준으로 보면 2.5 μM일 때 95.88%, 5.0 μM일 때 77.30%, 10.0 μM일 때 67.39%, 20.0 μM일 때 64.13%의 생존율을 보였으며 40.0 μM일 때 생존률은 19.71%로 가장 낮았다. 2.5 μM을 제외한 나머지 군은 빛 조사를 하지 않은 군과 비교했을 때 통계적으로 유의한 차이를 보였으며 농도가 증가함에 따라 세포의 생존율은 유의하게(p<0.001) 감소되었다(Fig. 4). A2E는 망막색소상피세포 내 시각 활동의 부산물로써 인체가 사물을 인식하는 과정에서 꾸준히 축적되는 형광색소물질이다. 이러한 특징으로 인해 건성황반변성은 서서히 진행하게 되며, 나이가 증가함에 따라 그 증상이 확연하게 드러나게 된다. 50세 이상에서 보다 80세 이상에서 유병률이 크게 증가하는 것은 이와 같이 망막색소상피세포 내에 A2E의 축적이 증가하게 되고, 축적된 A2E가 청색광을 포함한 다양한 광원에서 발생하는 빛에 의해 광산화가 일어나 세포사멸을 일으키는 것이라고 생각할 수 있다. 본 연구에서는 배양 망막색소상피세포에 A2E의 축적농도가 증가할수록 스마트기기 빛 조사에 의해 세포사멸이 유의하게 증가되는 것으로 확인되었다.
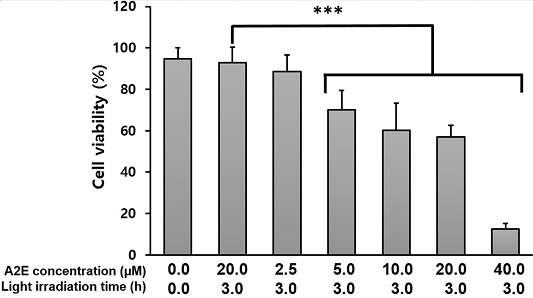
Cell viability of A2E-loaded ARPE-19 cells depending on A2E concentrations with 3 h irradiation of smart device light. ***p<0.001, significantly different from each group compared
스마트기기 빛 조사 시간을 1.5시간, 3.0시간, 6.0시간, 12.0시간으로 조사하였을 때 A2E가 축적되지 않은 ARPE-19 세포와 A2E가 축적된 ARPE-19 세포의 생존율을 측정하였다. A2E가 축적되지 않은 세포에서는 세포 생존율에 변화가 관찰되지 않았다(Fig. 5).
A2E가 축적된 세포에서는 빛 조사 1.5시간에서는 82.17±9.56%, 3.0시간에서는 55.99±12.42%, 6.0시간에서는 48.26±10.64%, 그리고 12.0시간에서는 7.18±2.25%의 생존율이 확인되었다. 이러한 결과는 빛 조사를 하지 않은 세포의 생존율을 기준으로 볼 때 1.5시간은 89.72%, 3.0시간은 65.53%, 6.0시간은 55.81% 생존율를 보였으며 특히, 12.0시간 빛 조사에서 생존율은 14.73%로 가장 큰 사멸 효과를 보였다(Fig. 6). 1.5시간 빛 노출 시에는 10.25% 세포생존율이 감소되었지만 통계적 유의성은 보이지 않았고, 1.5시간 빛 조사를 제외한 나머지 군에서는 빛 조사를 하지 않은 군에 비해 통계적으로 유의한 감소를 확인할 수 있었다(p<0.001). 시간대별 차이를 비교해 보면 1.5시간과 3.0시간, 6.0시간과 12.0시간의 생존율 감소는 각각 통계적으로 유의하였지만(p<0.001), 3.0시간 빛 조사와 6.0시간 빛 조사 사이에는 통계적 유의성은 없었다. 빛 조사 시간대별 감소 경향을 확인하기 위해 회기분석을 실시한 결과, R2값이 0.8952로 시간이 지남에 따라 생존율이 감소하는 경향은 보이지만 시간 의존적으로 일정하게 감소하는 것은 확인할 수 없었다.
태양광의 청색광 함유 비율이 약 12%인 것에 비해 스마트기기 LED화면의 청색광 비율은 약 35%로 자연 백색광보다 높다. 또한, LED화면의 청색광 비율은 과거 아날로그 화면에 비해서도 15%이상 높은 것으로 보고되어 있다.[10] 기존 연구에서 진행한 실험에 따르면 청색광에 의한 A2E의 산화율은 52.95%였고, 스마트기기에 의한 산화율은 36.75%였다.[7] 하지만, 본 실험에서는 스마트기기에 의한 빛 조사에 따른 A2E가 축적된 ARPE-19 세포의 사멸은 빛 조사 시간의 차이는 있지만 청색광을 조사하였을 때와 비슷한 세포사멸이 관찰되었다. 이를 통해 스마트기기 화면에서 발생하는 빛에도 장시간 노출이 되면 망막색소상피세포의 사멸이 증가할 수 있음을 알 수 있다.
빛에 의한 망막의 광화학적 산화에 의해 광수용세포가 손상되면 광수용세포로부터 분리된 형광색소물질이 망막색소상피세포의 손상을 매개하게 되어 황반변성 유발이 가능하다.[11-14] 현대는 과거보다 더 많은 스마트기기의 사용으로 인해 눈은 더 많은 빛에 노출될 것이고, 이러한 시각환경의 변화는 통해 나이 관련 황반변성의 발병율에 영향을 미칠 수 있다. 특히, VR기기의 화면은 눈과의 거리가 5~10 cm 불과해 눈에 더 큰 영향을 미칠 뿐만 아니라 강한 볼록렌즈로 된 접안렌즈를 사용하기 때문에 더 많은 빛이 눈으로 수렴되어 광산화 손상은 어욱 증가하게 될 것이다. 따라서 본 연구결과에서 확인 한 바와 같이 A2E의 축적과 스마트기기 빛 조사로부터 발생하는 망막색소상피의 사멸을 방지하기 위한 광학적 방안이 지속적으로 연구되어어야 할 것이다.
결 론
나이 관련 황반변성의 치료는 유전자치료, 단백질 치료, 인공 망막 이식 등의 다양한 방법으로 시도되고 있지만 아직까지 적절한 치료법이나 약물이 밝혀지지 않았고, 예방이 최우선이라고 생각되고 있다. 본 연구에서 스마트기기 빛은 A2E가 축적된 망막색소상피세포의 사멸에 영향을 미치는 것으로 확인되었으며, 이는 A2E의 축적 농도가 증가하고 스마트기기의 빛 조사 시간 길어짐에 따라에 망막색소상피세포의 사멸을 증가시키는 것으로 확인되었다. 추후 스마트기기에서 발생하는 빛 조사가 세포사멸을 일으키는 기전에 관한 연구가 필요할 것이고 다양한 착색 렌즈나 청색광차단 렌즈들이 세포사멸 감소에 영향을 미치는가에 대한 연구를 지속적으로 진행해야 할 것이라고 생각된다.
Acknowledgments
본 논문의 일부내용은 2020년도 한국안광학회 동계학술대회에서 구연으로 발표되었음.
References
-
Kolb H, Linberg KA, Fisher SK. Neurons of the human retina: a Golhi study. J Comp Neurol. 1992;318(2):147-187.
[https://doi.org/10.1002/cne.903180204]

- Hyun HJ, Sohn JH, Ha DW, et al. Depletion of intracellular zinc and copper with TPEN results in apoptosis of cultured human retinal pigment epithelial cells. Invest Ophthalmol Vis Sci. 2001;42(2):460-465.
-
Sparrow JR, Fishkin N, Zhou J, et al. A2E, a byproduct of the visual cycle. Vision Res. 2003;43(28):2983-2990.
[https://doi.org/10.1016/S0042-6989(03)00475-9]

- Park SI. The effect of brown tinted or UV-A blocking ophthalmic lens against the photooxidation of A2E, a lipofuscin in retina. J Korean Ophthalmic Opt Soc. 2012; 17(1):91-97.
-
Park SI, Jang YP. The protective effect of brown-, gray-, and blue-tinted lenses against blue LED light-induced cell death in A2E-laden human retinal pigment epithelial cells. Ophthalmic Res. 2017;57(2):118-124.
[https://doi.org/10.1159/000452174]

-
Moon J, Yun J, Yoon YD, et al. Blue light effect on retinal pigment epithelial cells by display devices. Integr Biol(Camb). 2017;9(5):436-443.
[https://doi.org/10.1039/C7IB00032D]

-
Park SI. Effect of photooxidation of A2E, a lipofuscin in the retina, induced by smartphone light against the photooxidation by blue light blocking lenses. J Korean Ophthalmic Opt Soc. 2018;23(4):511-517.
[https://doi.org/10.14479/jkoos.2018.23.4.511]

- Parish CA, Hashimoto M, Nakanishi K, et al. Isolation and one-step preparation of A2E and iso-A2E, fluorophores from human retinal pigment epithelium. Proc Natl Acad Sci USA. 1998;95(25):14609-14613.
-
Park SI, Park SC, Kim SR, et al. Two-step purification method for aging pigments A2E and iso-A2E using medium pressure liquid chromatography. Bull Korean Chem Soc. 2016;37(9):1541-1544.
[https://doi.org/10.1002/bkcs.10903]

-
Hoffmann AM, Noga G, Hunsche. High blue light improves acclimation and photosynthetic recovery of pepper plants exposed to UV stress. Environ Exp Bot. 2015;109:254-263.
[https://doi.org/10.1016/j.envexpbot.2014.06.017]

-
Li ZL, Tso MO, Jampol LM, et al. Retinal injury induced by near-ultraviolet radiation in aphakic and pseudophakic monkey eyes: a preliminary report. Retina. 1990;10(4):301-314.
[https://doi.org/10.1097/00006982-199010000-00014]

-
Busch EM, Gorgels TG, van Norren D. Temporal sequence of changes in rat retina after UV-A and blue light exposure. Vision Res. 1999;39(7):1233-1247.
[https://doi.org/10.1016/S0042-6989(98)00233-8]

-
Lu H, Hunt DM, Ganti R, et al. Metallothionein protects retinal pigment epithelial cells against apoptosis and oxidative stress. Exp Eye Res. 2002;74(1):83-92.
[https://doi.org/10.1006/exer.2001.1101]

-
Hao W, Fong HK. Blue and ultraviolet light-absorbing opsin from the retinal pigment epithelium. Biochemistry. 1996;35(20):6251-6256.
[https://doi.org/10.1021/bi952420k]