블랜드 앨트먼 도표분석을 통한 비침습적 눈물막파괴시간 측정의 반복성과 재현성 평가

초록
본 연구는 Keratograph 5M과 자동굴절력계를 이용한 비침습적 눈물파괴시간(NITBUT) 측정의 반복성과 재현성을 평가하고자 하였다.
22명(평균연령=22.45±1.95세, 연령 범위: 20~27) 대상자의 우안을 대상으로 NITBUT를 측정하였다. NITBUT는 Keratograph 5M과 자동굴절력계(Topcon KR-8100P)를 이용하여 측정하였으며. 검사자내 그리고 검사자간 측정을 통한 반복성과 재현성은 블랜드 엘트먼 도표 분석을 하였다.
자동굴절계로 측정된 NITBUT는 8.04±1.30 sec, Keratograph 5M으로 측정된 NITBUT는 7.24±1.20 sec으로 통계적으로 유의한 차이를 보였다(p=0.042). 검사자내 반복성 평가에서, 자동굴절력계로 측정 시 일치한계(limit of agreement, LOA)의 상한값은 1.355, 하한값은 –2.842였다. 이에 따른 반복성 계수(repetability coefficient)는 2.098 sec였다. Keratograph 5M으로 LOA 상한값은 1.864, 하한값은 –1.208였다. 이에 따른 반복성 계수는 1.536 sec였다. 자동굴절력계로 측정시 검사자간 재현성 평가에서는 LOA 상한값은 3.532, 하한값은 –1.410였다. 이에 따른 반복성 계수는 2.471 sec였다.
본 연구에서는 Keratograph 5M이 자동굴절력계에 비해 일관성이 높게 나타났다. Keratograph 5M은 프레임당 22,000개의 지점에 대한 영상분석을 통한 측정인 반면, 자동굴절력계는 검사자가 마이어상 변화를 주관적으로 관찰한 것으로 1초의 평균차이, 0.74초의 반복성, 그리고 1.06초의 재현성은 자동굴절력계도 NITBUT 측정에 유용하게 적용될 수 있다고 사료된다. 하지만 안경원마다 사용기기가 다르고, 검사자가 다르면 측정치에 오차가 발생할 수 있으므로 각자의 기준범위를 마련하는 것이 필요하다.
Abstract
This study aimed to assess the repeatability and reproducibility of non-invasive tear break-up time(NITBUT) between the Keratograph 5M and an autorefractor.
NITBUT was measured on the right eye of twenty-two participants (mean age=22.45±1.95 years, range: 20-27) by both the OCULUS Keratograph 5M and an autorefractor (Topcon KR-8100P). Intra-and inter-observer agreement was analyzed using the Bland-Altman plot.
NITBUT was 8.04±1.30 sec and 7.24±1.20 sec (paired t-test, p=0.45) using an autorefractor and the Oculus Keratograph 5M, respectively. For inter-observer agreement, the upper limit of agreement (LOA) was 1.355 sec, the lower LOA was –2.842 sec and the coefficient of repeatability (CoR) was 2.098 sec measured using an autorefractor. The upper LOA, lower LOA, and the CoR were 1.864 sec, –1.208 sec, the and 1.536 sec, respectively, measured using the Keratograph 5M. For intra-observer agreement measured using an autorefractor, the upper LOA, lower LOA, and the CoR were 3.532 sec, –1.410 sec, the and 2.471 sec, respectively.
This study indicates that the Keratograph 5M provides better agreement than an autorefractor. Considering that the Keratograph 5M analyses 22,000 points of image per frame, a mean difference of 1 sec, repeatability of 0.74 sec, and reproducibility of 1.06 sec by subjective observation from the examiner using an autorefractor may be considered useful for NITBUT measurements. However, each optometric practice uses a different device, and different examiners can cause errors in measurements; therefore, it is necessary to have a normal value.
Keywords:
Tear Break-Up Time, Repeatability, Reproducibility, Non-invasive, Bland-Altman plot키워드:
눈물막파괴시간, 반복성, 재현성, 비침습적, 블랜드 앨트만 도표서 론
건강보험심사평가원 보건의료빅테이터에 의하면, 국내에서 매년 200만명 이상 안구건조증으로 병원을 방문하고 있으며, 2015년 216만7968명에서 2018년 257만4343명으로 꾸준한 증가를 보이고 있다.[1] 특히나 안구건조증 환자 10명 중 6명이 20~50대 였으며, 이 나이대 기준 안구건조증 여성 환자(68.7%)가 남성(31.3%)에 비해 2배 이상으로 보고되어, 안구건조증이 청장년층에 흔히 겪는 불편함이라 할 수 있다. 안구건조증과 관련된 국제학술조직인 Tear Film and Ocular Surface Society(TFOS)의 정의에 따르면, 안구건조증은 눈물층불안정, 눈물의 고장성(고삼투압), 안구표면 염증과 손상, 감각신경 이상으로 눈물층의 불균형으로 발생하는 안구표면의 다인성질환이라고 정의하고 있다.[2] 안구건조증은 안구의 불편함뿐 아니라, 시각적으로도 대비감도에 감소에 영향을 미친다고 밝혀진바 있다.[3] 국내의 한 연구에서는 안구건조증이 일상생활에서도 자신감 및 타인과의 관계에도 부정적 영향을 미치고, 우울증 및 자살 충동과도 연관이 있다고 알려져 있다.[4] 이런 안구건조증을 유발하는 원인으로는 눈물분비부족, 눈물증발과다 그리고 두 가지가 혼합된 형태로 분류하고 있다.[5] 눈물분비 부족의 대표적인 것으로는 자가면역 질환인 쇼그렌증후군이 있으며, 그 이외에는 나이에 따른 호르몬 변화, 항생제 및 항히스타민제와 같은 약물복용, 굴절교정 수술 등이 원인으로 알려져 있다. 안구건조증의 많은 부분을 차지하고 있는 눈물막 증발 과다는 마이봄샘염, 눈꺼풀테염과 같은 안구 내의 원인이 있으며, 외부환경적인 요인으로 바람, 습도, 콘택트렌즈 착용, 디지털디바이스 사용 등의 위험인자들로 보고되고 있다.[6-7] 국내에 한 논문에 의하면 디지털디바이스의 과다한 사용, 불규칙한 수면, 학습 습관, 그리고 콘택트렌즈 착용 등이 건조한 증상을 야기하는 주요한 원인이라고 보고한 바 있다.[8]
현대 생활과 관련하여 디지털디바이스 사용이 안구건조증에 유병률 증가와 관련한다고 보고 있으며,[9] Dana 등은 2005년에서 2012년 사이에 미국에서 안구건조증으로 진료를 받은 인원이 3배로 늘었다고 보고하고 있다.[10] 구체적인 유병률 관련하여 논문별로 차이가 있는데, 미국의 연구에서는 대상자의 14.4%,[11] 호주는 16.6%의 유병률을 보였다.[12] 아시아권 국가로는 대만이 33.7%,[13] 인도네시아는 27.5%,[14]로 보고되었으며, 일본은 연구에 따라서 적게는 16.5%에서 많게는 73.5%까지의 유병률이 보고되었다.[15-16] 국내 경우에 OSDI설문지를 이용한 연구에서는 안구건조증 유병률은 76.1%,[17] 중학생과 고등학생의 생활 형태 조사설문지에 의한 연구에서는 44.3%,[8] 대학생을 대상으로 한 연구에서 50.6%,[18] 인천 지역에서 50세 이상을 대상으로 실시한 연구는 26.2%,[19] 65세 이상의 657명을 대상으로 실시한 연구는 33.2%의 유병률을 보였다.[20] 이렇듯이 기존의 연구에서 서로 다른 유병률을 보이는 이유로는 안구건조증을 진단하는 표준화된 진단 방법이 없으며, 각 연구마다 안구건조증에 대한 서로 다른 진단기준과 서로 다른 진단 방법을 사용하고 있기 때문이다.[21] 안구건조증을 진단하는 방법으로는 주관적인 병력과 증상 등을 일상생활에 미치는 영향에 관한 질문으로 구성한 설문조사가 있으며, TFOS에서는 5개의 질문으로 구성된 dry eye questionnaire-5(DEQ-5), 12개의 질문으로 구성된 Ocular surface disease index(OSDI)를 안구건조증 진단에 유용한 설문지로 권장하고 있으며, OSDI가 시각적 불편함에 대한 체계적인 질문으로 더 널리 활용되고 있다.[21-22] 진단적인 검사로는 슬릿램프를 통한 안구 표면 확인(각결막 염색), 눈물막 파괴 시간(tear break-up time, TBUT), 쉬르머검사, 눈물띠 검사, 마이봄샘 형태 검사, 눈물 삼투압 검사 등이 있다. 열거된 여러 가지 검사 중에서 TBUT 검사가 눈물증발 과다에 대한 진단검사로는 가장 일반적으로 행해지고 있는 검사이다.[21] TBUT 검사는 형광염색물질인 플루오레신용액을 각막 전면에 점안 후, 완전 순목을 이후 순간부터 각막 전면의 눈물막이 어느 부위든 간에 눈물막이 깨지는 순간까지의 시간을 말한다.[23] TBUT는 다시 두 가지로 구분이 될 수 있는데, 형광물질인 플루오레신을 각막표면에 점안 후, 눈물막이 파괴되는 시간을 측정하는 침습적 방법(invasive fluorescein breakup time, FBUT)과 각막표면에 아무것도 점안하지 않은 채, 눈물막 파괴를 관찰하는 비침습적 눈물막파괴시간(non-invasive tear film break-up time, NITBUT)으로 나누어진다.[23-24] 하지만 FBUT의 경우, 플루오레신 자체가 눈물막의 안정성에 영향을 주게 되어 측정값에 오차가 발생할 수 있으며, 점안된 플루오레신량에 따라 오차가 발생할 수 있다고 보고 있다.[25] FBUT 검사를 통한 안구건조증 기준은 플루오레신 점안량에 따라서 5~10초 이내로 측정된 것을 기준으로 보고 있다.[26-27] 하지만 쇼그렌증후군으로 인한 안구건조증의 경우에는 그 측정값이 오차범위가 커진다고 보고 있으며,[28] 또 다른 단점으로는 검사자의 주관적 판단에 따른 오차가 지적되고 있다.[29] 반면 NITBUT 검사는 안구 표면 눈물막에 어떤 영향도 주지 않는 장점으로 최근 들어 많이 사용되고 있다. NITBUT는 각막 표면에 조명을 투사하여 반사되는 이미지를 관찰하는 것으로, 대표적인 기기로는 Oculus사의 Keratograph 5M으로 검사자의 주관적 측정이 필요 없이 기기가 자동으로 각막 전면에서 발생하는 눈물막의 불안정을 측정할 수 있다.[30] 이 기기는 백색의 플라시도링(Placido ring)을 각막 전면에 투사하여, 반사되는 이미지로 눈물막이 불안정하게 되는 것을 측정하게 된다.
안경사와 관련된 국내의 의료기사 등에 관한 법률상 플루오레신을 점안해야 하는 FBUT는 시행할 수 없으며,[31] Keratograph 5M와 같은 값비싼 기기를 안경원에서 갖추는 것은 쉬운 일은 아니다. 대안으로 NITBUT 방식의 일환으로 각막곡률계(keratometer)의 마이어상을 관찰하여 눈물막 불안정을 측정한 연구도 있다.[32-33] 이와 유사한 방식으로 자동 굴절력계(autorefractor)에서 플라시도링을 각막에 투영하는 기능이 있으며, 이런 기능을 이용하여 눈물막 파괴시간을 측정하기도 한다.[34]
본 연구의 목적은 안구건조증 유병률이 증가하고 있는 상황에서 국내 안경원에서 구비하고 있는 기기를 사용해 NITBUT를 측정한 후 그 일관성을 평가하고자 한다. 이를 위해 안경원에 일반적으로 구비된 자동굴절력계를 활용한 주관적 측정방식과 Oculus사의 Keratograph 5M를 이용한 자동 측정 방식 간의 일치성을 비교하고자 하며, 검사기기간의 측정치 신뢰성 분석에서 검사자내 변이(intra-observer variation)에 따른 반복성(repetability)과 검사자간 변이(inter-observer variation)에 따른 재현성(reproducibility) 분석에 권장되고 있는 bland altman plot를 통해 평가하고자 하였다.[35-37]
대상 및 방법
1. 대상
본 연구의 대상자는 콘택트렌즈를 착용하지 않고, 안구표면에 특정한 영향을 미칠 수술을 받은적이 없는 대학생 22명이 참여하였다. 본 연구의 목적상 기기 간의 반복성 그리고 검사자 간의 재현성에 대한 측정이 목적이므로, 대상자들이 안구건조증 진단여부를 특정하지는 않았다. 하지만 기존 문헌에서 안구건조증이 심한 경우에는 측정치의 오차범위가 커질 수 있다고 밝힌바 있고[28] 선별 검사적인 방법으로 OSDI 설문지가 유용하게 적용되고 있다는 점을 고려하여[21] 연구 참여대상자를 OSDI 점수 기준 경증 이하(22점 이하)로 한정하였다. 본 연구는 생명윤리위원회의 승인을 받은 후 진행되었으며, 모든 대상자의 동의를 얻었으며, 대상자들은 본 연구의 목적과 검사 내용을 숙지한 후 연구에 참여하였다(CUIRB-2020-0073).
2. 연구 방법
본 연구는 동일 검사자 반복성 및 다른 검사자 사이의 재현성을 측정하고자 한 명의 검사자는 자동굴절력계와 Keratograph 5M으로 NITBUT를 2회 측정하도록 하여, 첫 번째와 두 번째 측정 간의 반복성을 평가하고자 하였다. 재현성은 다른 검사자로 하여금 자동굴절력계로 동일한 대상자로 NITBUT를 측정하도록 하여, 첫 번째 검사자와의 측정치와 비교하여 재현성을 평가하였다.
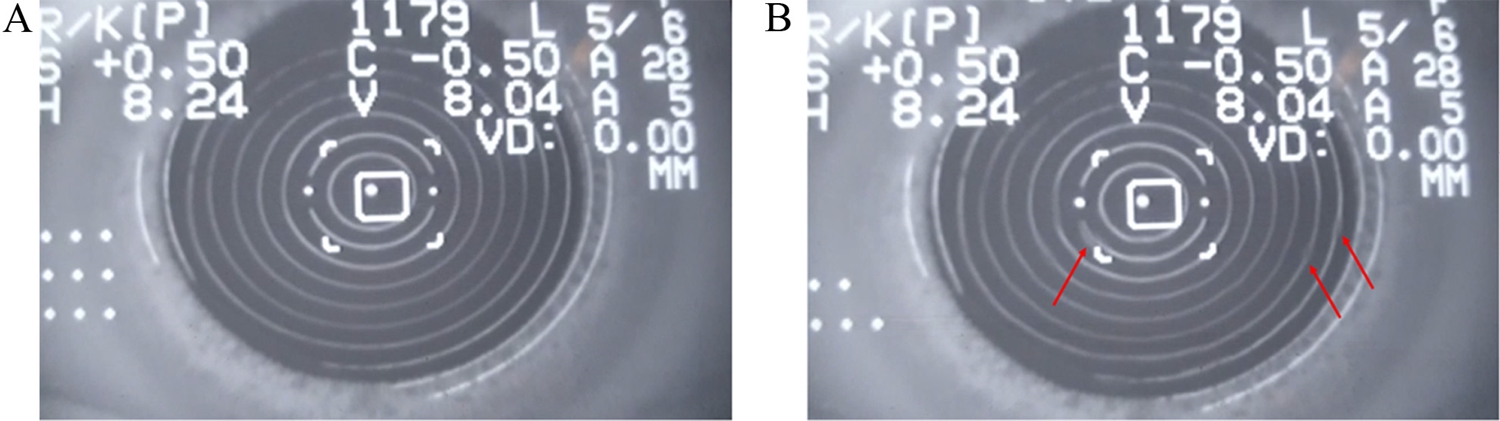
본 연구에서는 Topcon KR-8100P (Japan) 자동굴절력계를 사용하여 대상자들의 우안을 대상으로NITBUT를 측정하였다. Topcon KR-8100P는 각막 전면에 10개의 Placido링을 투영하며, 검사자는 각막 전면에 투영된 Placido링이 왜곡되는 순간까지의 시간을 주관적으로 평가하여 NITBUT를 측정하였다. 측정에 앞서 대상자에게 눈깜빡임을 두 번 하도록 한 후 눈을 뜬 상태에서 자동굴절력계의 중앙 타켓을 주시하도록 하였다. 이후 검사자는 모니터상에 눈물막의 특정 어느 부위라도 파괴되었다고 판단된 시간을 측정하도록 하였다. 첫 번째 측정 이후, 3분간의 휴식을 취한 후 2번째 측정을 반복하였다. 검사자들은 Keratograph 5M의 측정값을 알지 못하는 상태에서 측정하도록 하여, 측정치에 대한 편견을 배제하도록 하였다.
본 연구에 사용된 장비는 Keratograph 5M (Oculus, Germany)으로 기기 내의 적외선 파장을 이용하여 눈물막의 국소적인 파괴를 감지하여 NITBUT를 측정한다. 이 기기는 22개의 링을 각막표면에 투사하며, 하나의 링당 1,000여 개의 측정 지점을 선택하여, 프레임당 22,000개의 측정 지점을 분석하게 된다. 측정이 시작되면 녹화는 최대 25초간 촬영할 수 있으며, 혹은 대상자가 깜빡임을 할 때까지 촬영이 이루어진다. 본 기기는 NITBUT와 관련하여 2가지의 측정치를 제공하고 있는데, NITBUT-First는 눈물막의 어느 특정 부분이라도 파괴되는 최초의 시간에 대한 측정이며, NITBUT-Average는 측정되는 시간 동안 각막 전면의 모든 영역에서 눈물막이 파괴 되는데까지 걸린 시간의 평균 측정값이다.[34] 본 연구에서는 자동굴절력계의 측정치와 비교를 위하여 NITBUT-First 측정치로 분석을 하였다.
연구를 통하여 측정된 데이터는 통계분석 프로그램인 SPSS 20(IBM Corporation, Armonk, NY, USA)를 사용하였으며, 성별 간 평균 및 측정 기기 간 평균 비교는 paired t–test (two-tailed)를 사용하였다. 동일기기에 대한 측정 반복성과 검사자 간 측정 재현성 평가는 최근 연구에서 권장되고 있는 분석인 Bland-Altman plot 분석과 반복성계수를 산출하였다.[37] 추가적으로 자동굴절력계와 각막지형도를 이용한 반복 측정치에 대한 상관관계는 Spearman 상관관계 분석을 시행하였으며, r값이 0.2~0.4는 약학 상관관계이며, 0.4~0.7은 다소 높은 상관관계, 0.7~0.9는 높은 상관관계, 0.9이상은 매우 높은 상관관계가 있음으로 분석하였다. 통계적 유의성은 p<0.05일 때 통계적으로 유의성이 있는 것으로 판단하였다.
결과 및 고찰
1. 대상자
본 연구에 참여에 참여한 22명(남자 11명, 여자 11명)의 평균 연령은 23.45±1.95세(남자: 23.91±1.76, 여자: 23.00±2.10)이었으며, OSDI 평균점수는 13.81±3.29점(남자:13.64±4.03점, 여자: 14.00±2.53점)으로 대상자의 성별에 따른 OSDI 점수 차이는 없었다(p=0.402).
2. Keratograph 5M와 자동굴절계의 NITBUT
Keratograph 5M으로 자동측정된 NITBUT는 7.24±1.20초 자동굴절계로 측정된 NITBUT는 8.04±1.30초으로 통계적으로 유의한 차이를 보였다(p=0.042). 본 연구에서 사용된 Topcon KR-8100P를 이용하여 NITBUT를 측정한 기존 문헌은 없었으나, Keratograph 5M을 이용한 NITBUT 측정에 의하면, Lee 등의 연구에서는 8.39±6.00초,[34] Koh의 연구에서는 안구건조증 환자는 4.6±1.30초, 그리고 정상인 대상자는 9.7±6.70초로 측정되었다,[38] Keratograph 5M과 유사한 방식인 Medmont E300으로 측정한 NITBUT는 정상안은 19.4±5.30초, 안구건조증이 있는 경우에는 7.9±4.90초로 보고된 바 있다.[39] TFOS의 보고서에 의하면, 소프트웨어를 이용하여 NITBUT를 자동 측정하는 기기들 간에도 연구들 간 NITBUT의 범위가 4~19초로 밝히고 있으며, 검사자의 주관적 판단이 배제되어 있는 자동측정이어도 기기 간의 눈물막파괴를 판단하는 알고리즘 간의 차이가 존재하여 기기 간 측정값의 차이가 광범위하다고 밝히고 있다.[40] 자동굴절력계를 이용한 측정에서는 검사자가 각막전면에 반사되는 플라시도링의 왜곡 여부를 판단해야 하는 주관적 판단이 필요한데, 본 연구에서는 8.04±1.30초이었는데, 유사한 방식으로 각막 전면에 케라토미토 마이어상을 투사한 후 왜곡된 시간을 측정한 연구에서는 18.331±9.667초로 측정된 바 있으며,[41] Patel 등의 연구에서는 Bausch & Lomb사의 케라토미터를 이용하여 반사되는 상이 최초로 왜곡되는 시간을 Tear Thinning Time으로 정하고, 이 측정치를 18±6.5초로 밝힌바 있다.[32] 따라서 본 연구에서의 측정치와는 다소 차이가 있는데, 이는 연구간 사용기기의 차이와 대상자가 동일하지 않아 제한적인 비교만 가능할 것으로 판단된다.
3. 검사자내 NITBUT 측정의 반복성과 재현성
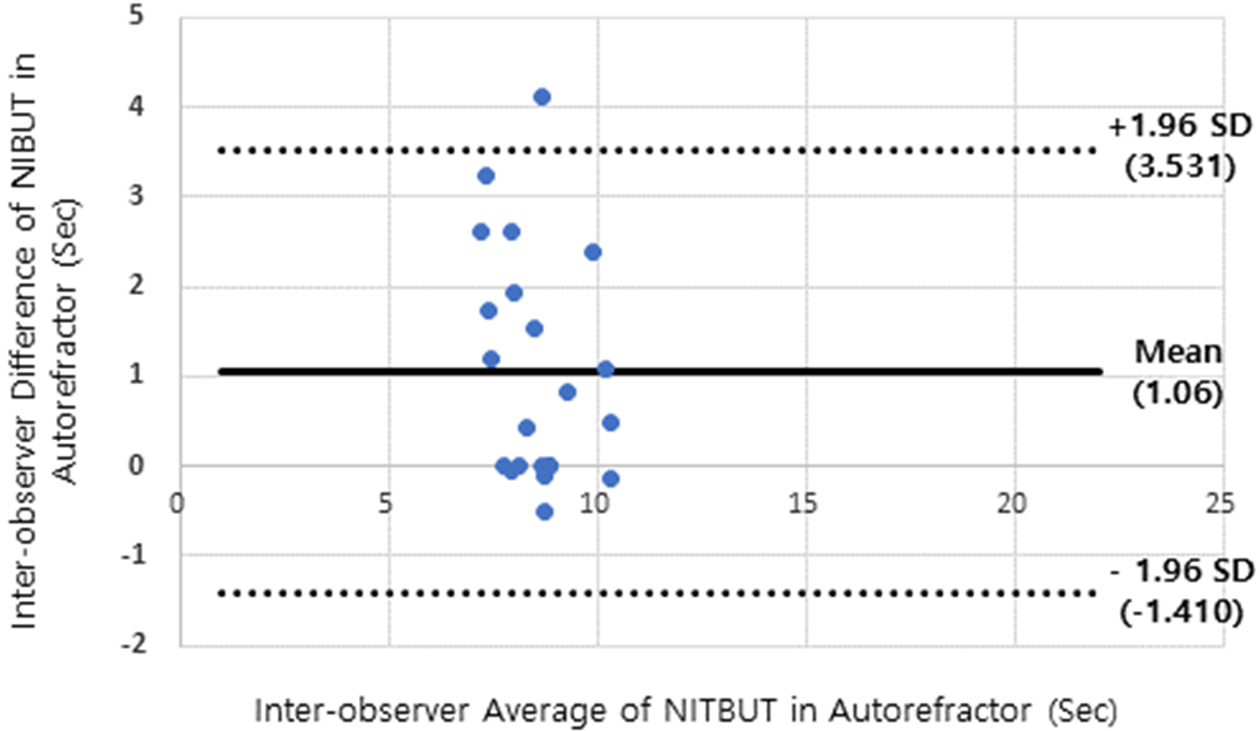
자동굴절력계로 검사자가 2회 측정하였을 때의 반복성 검사에서, 평균 차이는 0.74±1.07초, 95% 일치한계(limit of agreement, LOA)의 상한값은 1.355, 하한값은 –2.842였다. 이에 따른 반복성 계수(repetability coefficient)는 2.098이었다(Fig. 3). Keratograph 5M으로 검사자가 2회 측정하였을 때, 평균 차이는 0.33±0.78초, 95% 일치한계(limit of agreement, LOA)의 상한값은 1.864, 하한값은 –1.208였다. 이에 따른 반복성 계수는 1.536이었다(Fig. 4). 서로 다른 검사자가 자동굴절계를 이용하여 NITBUT를 측정하였을 때의 재현성 검사에서 평균 차이는 1.06±1.26초, 95% 일치한계(limit of agreement, LOA)의 상한값은 3.532, 하한값은 –1.410였다. 이에 따른 재현성 계수는 2.471이었다(Fig. 5). 기기의 신뢰도 평가에서 중요시 되는 항목은 반복성과 재현성이다. 반복성은 동일한 검사를 반복적으로 행하였을 때의 일치도를 평가하는 것이고, 재현성은 반복적인 측정에서 다른 변수가(검사자간) 개입되었을 때의 일치성을 평가하는 중요한 지표로, 새로운 기기를 기존의 표준화된 기기와 비교하는 연구에 있어서 필수적인 지표이다.[42] 본 연구에서도 안경원에서 사용할 수 있는 자동굴절력계를 이용한 측정에서 반복성 계수는 2.098이었고, Keratograph 5M으로 검사자가 2회 측정하였을 때, 반복성 계수는 1.536이었다. 이는 Keratograph 5M에 내장된 자동 소프트웨어가 NITUBT 측정에 있어서 일관성이 더 높은 것으로 나타난 것이다. 본 연구에 사용된 Topcon KR-8100P도 플라시도링을 투영하여 반사되는 상의 왜곡을 판단하는 동일한 원리이지만, 왜곡 여부를 검사자의 주관적인 관점에서 판단하여야 하는 반면, Keratograph 5M은 안구전면에 22,000개의 측정지점을 가지고 있으며 초당 32프레임의 이미지를 분석할 수 있어,[34] 일관성이 높다고 판단된다. 반면 일부 논문에서는 Keratograph 5M으로 측정한다고 해도 대상자가 안구건조증이 있는지의 여부에 따라서 반복성에 영향을 미친다고 보고하였는데, Hong 등의 연구에서는 신뢰성이 높은 반면,[43] Cox 등의 연구에서는 상대적으로 낮다고 보고한바 있다.[44] 자동화된 기기임에도 상반된 결과가 나타나는 것은 대상자의 안구건조증 여부에 따라서 영향을 미칠 수 있다고 보고 있다.[30]

Bland-Altman plot of intra-observer difference of NITBUT using an autorefractor. The mean difference is shown by the solid black line, the limits of agreement by the dashed lines.

Bland-Altman plot of intra-observer difference of NITBUT using the Keratograph 5M. The mean difference is shown by the solid black line, the limits of agreement by the dashed lines.
4. 검사자내 반복 측정 간의 상관 관계
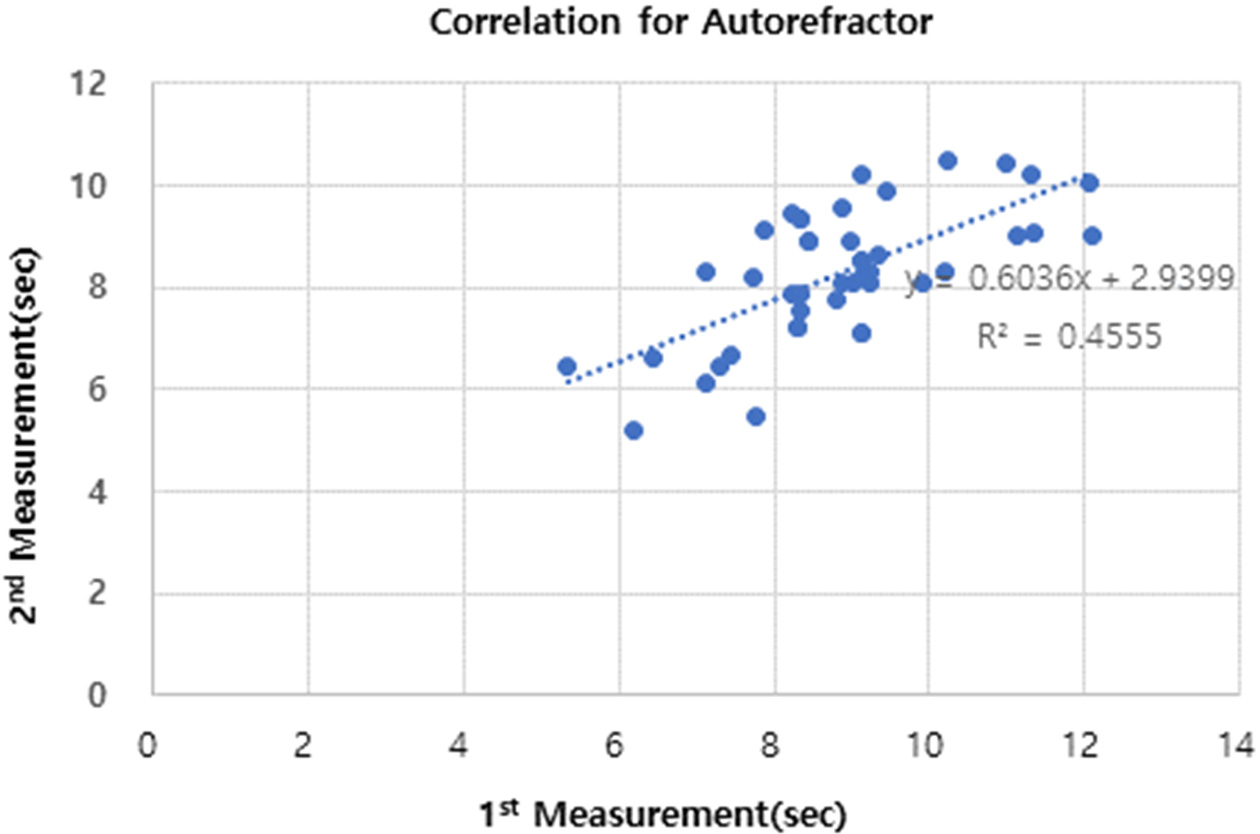
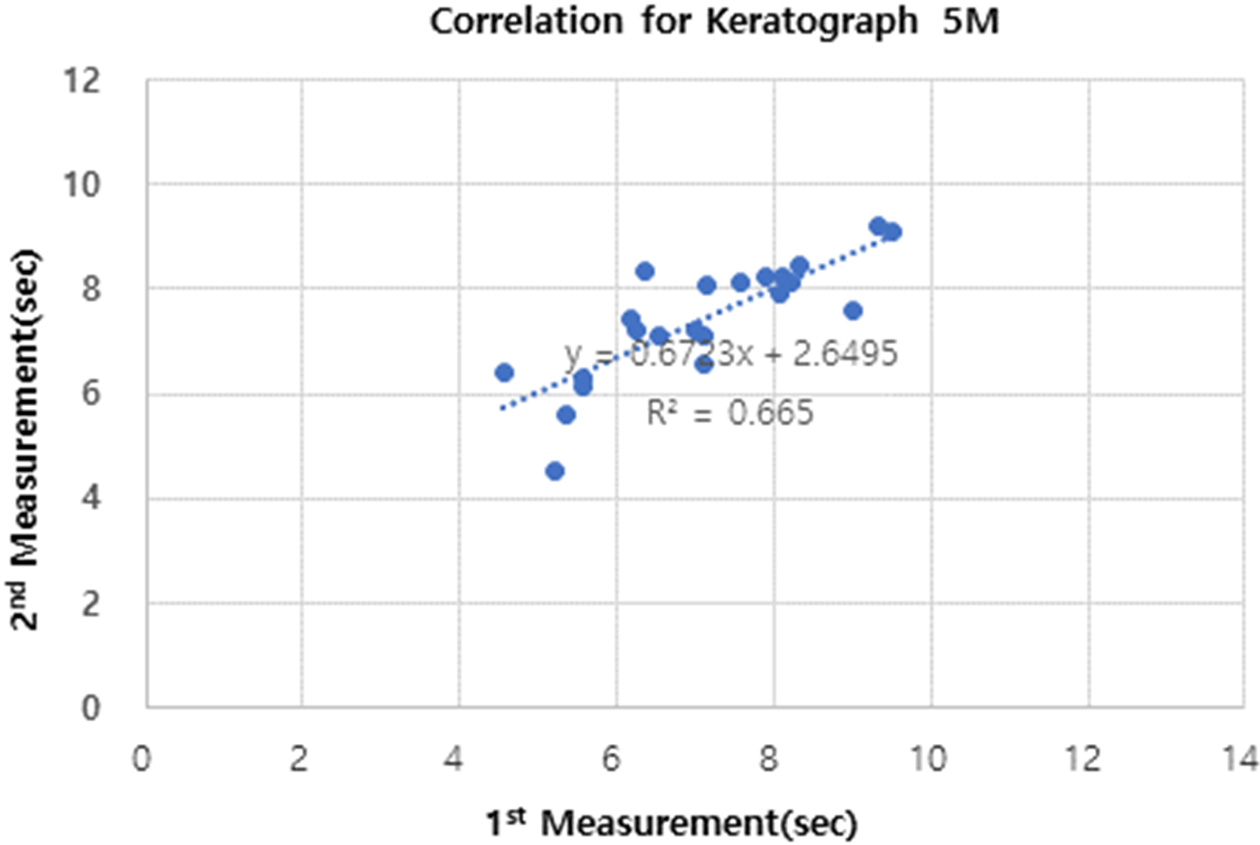
동일 검사자가 자동굴절검사계를 사용하여 반복 측정시, 첫 번째 측정치와 두 번째 측정치간의 상관관계를 분석한 결과, 상관 계수는 0.675로 다소 높은 상관 관계를 보였다(Fig. 6). 동일 검사자가 Keratograph 5M으로 반복 측정시, 첫 번째 측정치와 두 번째 측정치간의 상관계수는 0.815로 높은 상관관계를 보였다(Fig. 7). Lee 등의 연구에서도 Tomey RT-7000의 자동굴절계를 사용하였는데, 본 연의 상관관계가 낮다고 보고한바 있다. 상관관계가 낮은 원인은 Tomey RT-7000의 측정이 15개의 마이어상을 이용하고, 초당 1개의 상을 촬영하며, 3,840지점을 분석한다고 밝힌 바 있다.[34] 따라서 자동적으로 NITUBT를 측정하는 기기 간에도 해상도 및 건조지점 파악 및 상의 왜곡 여부를 판단하는 알고리즘이 다름으로 인해서 오차가 있다고 할 수 있다. 추가적으로 본 연구에서는 검사자 간의 측정 시 재현성을 평가하였으며 반복성 계수가 2.471이었는데, 검사자간의 왜곡에 대한 판단 기준이 다를 수 있다는 것에 기인하다고 판단된다. TFOS에서 권고하는 안구건조증 진단 TBUT를 10초 내외로 밝히고 있지만,[21] 안구건조증을 진단하는데 있어서 TBUT는 진단을 위한 여러 가지 검사 중 하나로써, 절대적인 수치는 아니라고 할 수 있다. 따라서 본 연구에서 나타난 검사자간 반복성 계수인 2.471는 다른 진단 검사 결과에 따라서 함께 분석되어야 할 수치로 사료 된다. 또한 NITBUT를 측정하는 다양한 기기들이 계속해서 출시되고 있으구의 자동굴절력계와는 다르게 자동적으로 NITBUT를 측정하는 소프트웨어를 내장하고 있어, 검사자의 주관적인 판단이 개입되지 않았음에도 불구하고, Keratograph 5M과 비교 측정한 값므로, 상호간 측정치에 대한 연관성을 높일 수 있는 추가적인 연구들이 필요할 것으로 사료된다.
결 론
본 연구에서는 국내 안경원에서 사용되고 있는 자동굴절력계의 마이어상 관찰을 통한 NITBUT 측정의 반복성과 재현성을 측정하였다. 병원 및 연구기관에서 사용되고 있는 Keratograph 5M의 측정치와 비교하였을 때 자동굴절력계는 1초가량 더 걸리는 것으로 측정되었다. Keratograph 5M은 초당 수만개의 지점을 분석하여 측정하는 반면, 자동굴절력계의 마이어상 변화를 주관적으로 판단한 것을 감안하면, 1초의 평균차이, 0.74초의 반복성, 그리고 1.06초의 재현성은 자동굴절력계도 NITBUT 측정에 유용하게 적용될 수 있다고 사료된다. 본 연구의 제한사항으로는 연구대상자를 OSDI 기준 경증이하로 제한하여 정상적인 눈물막을 가진 대상만을 포함한 것이라고 할 수 있다. 또한 한가지 기종으로 측정을 하여, 실제 다양한 기기를 사용하는 안경원에서 결과를 직접적으로 적용하는데 한계가 있다. 따라서 향후 안구건조증이 중증 이상이거나 콘택트렌즈 착용등으로 눈물막에 영향을 줄 수 있는 대상자로 실험을 진행하는 것이 필요할 것으로 판단된다. 추가적으로 국내 안경원에서 사용되는 다양한 기기를 포함한 연구가 진행된다면 국내 안경원에서 연구의 결과를 현장에 적용하는데 도움이 될 수 있을것으로 사료된다.
Acknowledgments
This work was supported by a sabbatical research grant from Daegu Catholic University in 2021.
Conflict of interest
The authors conclude that they have no interest in the products associated with this study.
References
- Health Insurance Review and Assessment Service. Healthcare Bigdata Hub, 2021. https://opendata.hira.or.kr/home.do, (31 August 2021).
-
Jennifer P, Nichols KK, Akpek EK, et al. TFOS DEWS II definition and classification report. Ocul Surf. 2017;15(3):276-283.
[https://doi.org/10.1016/j.jtos.2017.05.008]

-
Rolando M, Iester M, Macrí A, et al. Low spatial-contrast sensitivity in dry eyes. Cornea. 1998;17(4):376-379.
[https://doi.org/10.1097/00003226-199807000-00006]

-
Um SB, Yeom H, Kim NH, et al. Association between dry eye symptoms and suicidal ideation in a Korean adult population. PLoS One. 2018;13(6):e0199131.
[https://doi.org/10.1371/journal.pone.0199131]

-
Jun S. Definition and diagnostic criteria of dry eye disease: Historical overview and future directions. Invest Ophthalmol Vis Sci. 2018;59(14):7-12.
[https://doi.org/10.1167/iovs.17-23475]

-
Bron AJ, de Paiva CS, Chauhan SK, et al. TFOS DEWS II pathophysiology report. Ocul Surf. 2017;15(3):438-510.
[https://doi.org/10.1016/j.jtos.2017.05.011]

-
Brewitt H, Sistani F. Dry eye disease: the scale of the problem. Surv Ophthalmol. 2001;45(2):199-202.
[https://doi.org/10.1016/S0039-6257(00)00202-2]

-
Lee JJ, Sung JY, Lee SB. Prevalence of dry eye syndrome and association with life behaviors in adolescents. J Korean Ophthalmol Soc. 2017;58(4):387-394.
[https://doi.org/10.3341/jkos.2017.58.4.387]

-
Wang MTM, Muntz A, Mamidi B, et al. Modifiable life-style risk factors for dry eye disease. Cont Lens Anterior Eye. 2021:44(6):101409.
[https://doi.org/10.1016/j.clae.2021.01.004]

-
Dana R, Bradley JL, Guerin A, et al. Estimated prevalence and incidence of dry eye disease based on coding analysis of a large, all-age United States health care system. Am J Ophthalmol. 2019;202:47-54.
[https://doi.org/10.1016/j.ajo.2019.01.026]

-
Moss SE, Klein R, Klein BEK, et al. Prevalence of and risk factors for dry eye syndrome. Arch Ophthalmol. 2000;118(9):1264-1268.
[https://doi.org/10.1001/archopht.118.9.1264]

-
Chia EM, Mitchell P, Rochtchina E, et al. Prevalence and associations of dry eye syndrome in an older population: the blue mountains eye study. Clin Experiment Ophthalmol. 2003;31(3):229-232.
[https://doi.org/10.1046/j.1442-9071.2003.00634.x]

-
Lin PY, Tsai SY, Cheng CY, et al. Prevalence of dry eye among an elderly Chinese population in Taiwan: the shihpai eye study. Ophthalmology. 2003;110(6):1096-1101.
[https://doi.org/10.1016/S0161-6420(03)00262-8]

-
Lee AJ, Lee J, Saw SM, et al. Prevalence and risk factors associated with dry eye symptoms: a population based study in Indonesia. Br J Ophthalmol. 2002;86(12):1347-1351.
[https://doi.org/10.1136/bjo.86.12.1347]

-
Uchino M, Dogru M, Yagi Y, et al. The features of dry eye disease in a Japanese elderly population. Optom Vis Sci. 2006;83(11):797-802.
[https://doi.org/10.1097/01.opx.0000232814.39651.fa]

-
Uchino M, Nishiwaki Y, Michikawa T, et al. Prevalence and risk factors of dry eye disease in Japan: Koumi study. Ophthalmology. 2011;118(12):2361-2367.
[https://doi.org/10.1016/j.ophtha.2011.05.029]

-
Han SH, Kim EY. Prevalence of dry eye disease its affecting factors by using OSDI. Journal of the Korea Academia-Industrial cooperation Society. 2016;17(10):93-103.
[https://doi.org/10.5762/KAIS.2016.17.10.93]

-
Yun CM, Kang SY, Kim HM, et al. Prevalence of dry eye disease among university students. J Korean Ophthalmol Soc. 2012;53(4):505-509.
[https://doi.org/10.3341/jkos.2012.53.4.505]

-
Jeong HS, Lim JS, Oh DG, et al. Prevalence and risk factors of dry eye syndrome in the Incheon area. J Korean Ophthalmol Soc. 2011;52(10):1135-1141.
[https://doi.org/10.3341/jkos.2011.52.10.1135]

-
Han SB, Hyon JY, Woo SJ, et al. Prevalence of dry eye disease in an elderly Korean population. Arch Ophthalmol. 2011;129(5):633-638.
[https://doi.org/10.1001/archophthalmol.2011.78]

-
Wolffsohn JS, Arita R, Chalmers R, et al. TFOS DEWS II diagnostic methodology report. Ocul Surf. 2017;15(3):539-574.
[https://doi.org/10.1016/j.jtos.2017.05.001]

-
Chalmers RL, Begley CG, Caffery B. Validation of the 5-item dry eye questionnaire(DEQ-5): discrimination across self-assessed severity and aqueous tear deficient dry eye diagnoses. Cont Lens Anterior Eye. 2010;33(2):55-60.
[https://doi.org/10.1016/j.clae.2009.12.010]

-
Lemp MA. Breakup of the tear film. Int Ophthalmol Clin. 1973;13(1):97-102.
[https://doi.org/10.1097/00004397-197301310-00008]

-
Norn MS. Desiccation of the precorneal film: I. corneal wetting time. Acta Ophthalmol. 1969;47(4):865-880.
[https://doi.org/10.1111/j.1755-3768.1969.tb03711.x]

-
Mooi JK, Wang MTM, Lim J, et al. Minimising instilled volume reduces the impact of fluorescein on clinical measurements of tear film stability. Cont Lens Anterior Eye. 2017;40(3):170-174.
[https://doi.org/10.1016/j.clae.2017.01.004]

-
Abelson MB, Ousler GW, Nally LA, et al. Alternative reference values for tear film break up time in normal and dry eye populations. Adv Exp Med Biol. 2002;506:1121-1125.
[https://doi.org/10.1007/978-1-4615-0717-8_157]

-
Abelson R, Lane KJ, Rodriguez J, et al. A single-center study evaluating the effect of the controlled adverse environment( CAE(SM)) model on tear film stability. Clin Ophthalmol. 2012;6:1865-1872.
[https://doi.org/10.2147/OPTH.S33905]

-
Sullivan BD, Crews LA, Sonmez B, et al. Clinical utility of objective tests for dry eye disease: variability over time and implications for clinical trials and disease management. Cornea. 2012;31(9):1000-1008.
[https://doi.org/10.1097/ICO.0b013e318242fd60]

-
Ramos L, Barreira N, Mosquera A, et al. Analysis of parameters for the automatic computation of the tear film break-up time test based on CCLRU standards. Comput Methods Programs Biomed. 2014;113(3):715-724.
[https://doi.org/10.1016/j.cmpb.2013.12.003]

-
Tian L, Qu J, Zhang X, et al. Repeatability and reproducibility of noninvasive keratograph 5M measurements in patients with dry eye disease. J Ophthalmol. 2016;8013621:1-6.
[https://doi.org/10.1155/2016/8013621]

- Ministry of Health and Welfare. Medical Service Technologists, ETC, 2020. https://www.law.go.kr/LSW/lsLink-Proc.do?lsNm=%EC%9D%98%EB%A3%8C%EA%B8%B0%EC%82%AC+%EB%93%B1%EC%97%90+%EA%B4%80%ED%95%9C+%EB%B2%95%EB%A5%A0&chrClsCd=010202&mode=20&ancYnChk=0, (31 August 2021).
-
Patel S, Murray D, Mckensie A, et al. Effects of fluorescein on tear breakup time and on tear thinning time. Optom Vis Sci. 1985;62(3):188-190.
[https://doi.org/10.1097/00006324-198503000-00006]

-
Sweeney DF, Millar TJ, Raju SR, et al. Tear film stability: a review. Exp Eye Res. 2013;117:28-38.
[https://doi.org/10.1016/j.exer.2013.08.010]

-
Lee R, Yeo S, Aung HT, et al. Agreement of noninvasive tear break-up time measurement between Tomey RT-7000 auto refractor-keratometer and Oculus Keratograph 5M. Clin Ophthalmol. 2016;10:1785-1790.
[https://doi.org/10.2147/OPTH.S110180]

-
Bland JM, Altman DG. Statistical methods for assessing agreement between two methods of clinical measurement. The Lancet. 1986;327(8476):307-310.
[https://doi.org/10.1016/S0140-6736(86)90837-8]

-
Zaki R, Bulgiba A, Ismail R, et al. Statistical methods used to test for agreement of medical instruments measuring continuous variables in method comparison studies: a systematic review. PLoS One. 2012;7(5):e37908.
[https://doi.org/10.1371/journal.pone.0037908]

-
Kong KA. Statistical methods: reliability assessment and method comparison. The Ewha Medical Journal. 2017;40(1):9-16.
[https://doi.org/10.12771/emj.2017.40.1.9]

-
Koh S, Ikeda C, Fujimoto H, et al. Regional differences in tear film stability and meibomian glands in patients with aqueous-deficient dry eye. Eye Contact Lens. 2016;42(4):250-255.
[https://doi.org/10.1097/ICL.0000000000000191]

-
Downie LE. Automated tear film surface quality breakup time as a novel clinical marker for tear hyperosmolarity in dry eye disease. Invest Ophthalmol Vis Sci. 2015;56(12):7260-7268.
[https://doi.org/10.1167/iovs.15-17772]

-
Willcox MDP, Argüeso P, Georgiev GA, et al. TFOS DEWS II tear film report. Ocul Surf. 2017;15(3):366-403.
[https://doi.org/10.1016/j.jtos.2017.03.006]

-
Hirji N, Patel S, Callander M. Human tear film pre-rupture phase time(TP-RPT)- a non-invasive technique for evaluating the pre-corneal tear film using a novel keratometer mire. Ophthalmic Physiol Opt. 1989;9(2):139-142.
[https://doi.org/10.1111/j.1475-1313.1989.tb00833.x]

-
McAlinden C, Khadka J, Pesudovs K. Statistical methods for conducting agreement(comparison of clinical tests) and precision(repeatability or reproducibility) studies in optometry and ophthalmology. Ophthalmic Physiol Opt. 2011;31(4):330-338.
[https://doi.org/10.1111/j.1475-1313.2011.00851.x]

-
Hong J, Sun X, Wei A, et al. Assessment of tear film stability in dry eye with a newly developed keratograph. Cornea. 2013;32(5):716-721.
[https://doi.org/10.1097/ICO.0b013e3182714425]

-
Cox SM, Nichols KK, Nichols JJ. Agreement between automated and traditional measures of tear film breakup. Optom Vis Sci. 2015;92(9):257-263.
[https://doi.org/10.1097/OPX.0000000000000648]