
몽골리안 저빌 망막에서 콜린성 무축삭세포의 면역세포화학적 분포: 칼슘결합단백질 Calretinin과의 Colocalization

초록
몽골리안 저빌 망막에서 콜린성 무축삭세포의 분포 양상을 연구하고자 한다.
면역세포화학법과 공초점 현미경을 이용하여 몽골리안 저빌 망막에서 콜린 아세틸전이효소 면역반응(choline acetyltransferase-immunoreactive, ChAT-IR) 세포의 분포를 조사하였다. 또한 ChAT-IR 세포의 밀도를 정량적으로 분석하였다.
ChAT-IR 세포는 속핵층과 신경절세포층에 존재했으며, 이러한 세포의 돌기들은 이전에 다양한 동물에서 보고된 바와 같이 내망상층에서 두 층의 뚜렷한 좁은 밴드를 형성하였다. 신경절세포층에서 ChAT-IR 세포의 평균 밀도는 1,242 ± 111 cell/mm2, 속핵층에서 1,487 ± 257 cell/mm2로 속핵층에서 ChAT-IR 세포의 수가 신경절세포층에서 보다 더 많다. 몽골리안 저빌 망막의 ChAT-IR 무축삭세포는 칼슘결합단백질인 calretinin을 발현하고 있지만, calbindin-D28K나 parvalbumin은 발현하지 않았다.
분포 양상은 몽골리안 저빌 망막의 콜린성 무축삭세포가 다른 동물과 유사하다는 것을 보여주며, 콜린성 무축삭세포에서 칼슘결합단백질의 발현 결과는 동물마다 종 특이적일 수 있음을 보여주고 있다. 콜린성 무축삭세포는 망막의 동작 감지 메커니즘에서 중요한 역할을 하는 것으로 알려져 있으므로 몽골리안 저빌 망막에 대한 현재 연구는 주행성 동물 모델의 추가 생리학적 연구에 더 나은 정보를 제공할 수 있을 것으로 사료된다.
Abstract
To study the distribution pattern of cholinergic amacrine cells in the diurnal Mongolian gerbil retina.
Immunocytochemistry and confocal microscopy were used to investigate the localization of choline acetyltransferase-immunoreactive (ChAT-IR) cells in the gerbil retina. The cell density of ChAT-IR cells was quantitatively analyzed.
ChAT-IR cells were present in the inner nuclear layer and the ganglion cell layer; the processes of these cells form two distinct narrow bands in the inner plexiform layer, as previously reported in various animals. The average density of ChAT-IR cells in the ganglion cell layer was 1,242±111 cells/mm2 and 1,487±257 cells/mm2 in the inner nuclear layer, demonstrating the number of ChAT-IR cells in the inner nuclear layer was higher than that in the ganglion cell layer. The cholinergic amacrine cells in the gerbil retina contained the calcium-binding protein calretinin but not calbindin-D28K or parvalbumin.
The distributional pattern shows that cholinergic amacrine cells in the gerbil retina are similar to those in other animals. Calcium-binding proteins expression in cholinergic amacrine cells are species-specific. The cholinergic amacrine cells play key roles in the motion detection mechanisms in the retina. Therefore, this study on the gerbil retina may provide better information for further physiological studies involving a diurnal animal model.
Keywords:
Mongolian gerbil, Retina, Cholinergic amacrine cells, Calcium-binding proteins, Immunocytochemistry키워드:
몽골리안 저빌, 망막, 콜린성 무축삭세포, 칼슘결합단백질, 표준면역세포화학법서 론
망막 무축삭세포(amacrine cell)는 두극세포(bipolar cell)와 신경절세포(ganglion cell)를 연결하는 사이신경세포(interneuron)로 포유류 망막 속핵층(inner nuclear layer)의 세포 중 약 40%를 차지하고 적어도 약 30종류 이상으로 분류된다.[1-3] 이 중 AII 무축삭세포와 성화상 무축삭세포(starburst amacrine cells)가 가장 많이 연구되어 있으며 성화상 무축삭세포는 처음에 콜린성 뉴런(cholinergic neuron)으로 확인되었고 이후에 흥분성 신경전달물질인 아세틸콜린(acetylcholine)과 억제성 신경전달물질인 감마-아미노부티르산(gamma-aminobutyric acid, GABA)을 모두 방출하는 것으로 나타났다.[4-7] 콜린성 무축삭세포(cholinergic amacrine cells)인 성화상 무축삭세포는 토끼[4,8,9]에서 연구가 처음 시작된 후 거북이, [10] 생쥐,[11,12] 쥐,[13,14] 땅다람쥐,[15] 고양이,[16] 영장류[17,18] 등의 여러 동물에서 연구되었다. 이들 세포는 속핵층과 신경절세포에 분포하며 방사형의 일정한 형태를 가진 수상돌기가 세포체를 중심으로 동심원형태로 고르게 분포되는 ‘성화상’ 형태가 특징이다.[4]
시각적 움직임의 방향을 인코딩하는 기능을 ‘방향 선택(direction-selective)’이라고 하는데 방향 선택성을 결정하는 망막 세포에 대해서는 1965년 Barlow와 Levick의 방향 특이성에 대한 첫 발표를 시작으로 여러 연구들이 진행되고 있다.[3,4,19-21] 망막에서 방향 선택성 기전의 연구 결과는 대부분 전기 생리학적 및 약리학적 연구 결과로 뉴런이 발견된 지 60년 이상이 지난 지금도 방향 선택성의 정확한 메커니즘에 대해 활발한 연구가 진행되고있다.[3,22] 망막의 무축삭세포는 두극세포, 신경절세포 및 다른 종류의 무축삭세포와 다양한 시냅스를 형성하고 있지만 아직도 많은 무축삭세포의 기능은 잘 알려져 있지 않고 있다.[23] 콜린성 무축삭세포는 포유류 망막에서 AII 무축삭 세포를 제외하고 가장 많은 무축삭세포이며 또한 가장 많이 연구가 이뤄지고 있는 세포이다.[4,5,7,8] 콜린성 무축삭세포는 망막의 발달에 중요한 기능을 하는 것으로 알려져 있다.[7] 특별히 움직임을 인식하는 방향 선택성 계산에서 중요한 역할을 하는 것으로 알려져 있어 현재 콜린성 무축삭세포와 방향특이성 신경절세포와의 관계에 대한 많은 연구들이 이루어지고 있다.[20,24-27] 하지만 몽골리안 저빌에서의 연구는 이루어지고 있지 않다.
칼슘이 세포의 항상성을 조절하고 신경전달물질을 방출하는 등의 세포 대사과정에서 다양한 중요한 역할을 하는 것은 이미 잘 알려져 있다. 칼슘결합단백질(calcium-binding protein)은 칼슘과 결합하는 기능이 있는 단백질로 칼슘 이온 농도를 조절하여 칼슘 매개 신호전달에 중요한 역할을 하며 칼슘의 역할은 다양한 종류의 칼슘결합단백질에 의해서 달라질 수 있다.[28,29] 칼슘결합단백질은 중추신경계의 다양한 하위 신경세포집단에 존재하고 있다고 알려져 있으며 특별히 GABA성 사이신경세포의 하위를 구분하는 중요한 표시자의 역할도 하고 있다.[29-32] 면역세포화학적 분석을 통해 망막에서도 칼슘결합단백질의 발현에 관한 연구가 활발히 수행되었는데, 특별히 칼슘결합단백질 중에서 대표적인 3종류의 calbindin-D28K, calretinin 및 parvalbumin이 망막에서 많이 연구되어왔다.[4,26]
현재까지의 다양한 연구들에 의하면 범무늬도롱뇽과 도롱뇽목에 속하는 머드퍼피 망막에서 calbindin-D28K는 원뿔광수용세포, 수평세포, 일부 두극세포, 일부 무축삭세포 및 신경절세포층의 세포에서 관찰되고, calretinin은 대부분의 두극세포, 수평세포, 일부 무축삭세포 및 많은 신경절세포에서 관찰되고, parvalbumin은 일부 수평세포와 소수의 무축삭세포가 관찰되었다.[33] 생쥐 망막에서 calbindin-D28K는 수평세포, 여러 유형의 무축삭세포 및 신경절세포, calretinin은 신경절세포, 무축삭세포, parvalbumin은 신경절세포 및 전위된 무축삭세포에서 관찰되었다.[34] 쥐망막에서 calbindin-D28K는 수평세포, 무축삭세포에서 관찰되고, calretinin은 무축삭세포 및 신경절세포에서, parvalbumin은 수평세포 및 AII 무축삭세포에서 관찰되었다.[14,35-37] 땅다람쥐 망막에서 calretinin은 수평세포, 두극세포 및 무축삭세포의 많은 하위 유형 세포에서 관찰되었다.[15] 토끼 망막에서 calbindin-D28K는 수평세포, 두극세포, 중대형 신경절세포에서, calretinin은 신경절세포층에 있는 AII 세포, 두극세포, 무축삭세포에서, parvalbumin은 AII 세포, 수평세포, 무축삭세포에서 관찰되었다.[38-40]
생쥐와 쥐는 작은 크기, 유지관리 용이성, 짧은 발달 주기 및 비교적 용이한 유전적 조작 가능성 등에 의해 생명과학 연구에서 가장 많이 이용되어왔다. 하지만 시각계의 연구에 있어서는 생쥐와 쥐는 야행성 동물로 망막에서 막대광수용세포가 지배적인 역할을 하여 색각 기능이 거의 없기 때문에 인간의 시각 연구에 부적절한 모델을 제공한다. 하지만, 몽골리안 저빌(Mongolian gerbil, Meriones unguiculatus)은 생쥐와 쥐에 비해 망막 원뿔광수용세포의 비율이 더 높은 주행성 동물로,[41-43] 더 높은 시력을 제공한다.[44] 또한, 몽골리안 저빌은 사람의 중심오목과 유사한 특화된 망막 영역을 가지고 있어,[42,43,45,46] 망막의 연구에 널리 이용되어 왔다. 또한 몽골리안 저빌 눈은 더 크고 주야간 활동의 주요 조절 역할을 하는 망막과 송과선 연구에 적합하여 좋은 연구 모델이 된다.[47] 하지만 발달 연구를 제외하고는 몽골리안 저빌 망막의 생리학 및 형태학에 대해서 많이 알려져 있지 않다.[47]
따라서 본 연구의 첫 번째 목표는 면역세포화학적 방법을 통해 방향 선택성에 가장 중요한 요소 중 하나인 콜린성 무축삭세포 분포를 정량 분석하고 공초점 현미경을 통해 몽골리안 저빌 망막에서 콜린성 무축삭세포의 형태학적인 분석 및 분포 양상을 연구하고자 한다. 비록 쥐의 망막에서 calbindin-D28K는 허혈 손상에 대한 보호기능을 하고,[48] calretinin은 인간 망막의 발달과 성숙에 관여하는 것으로 알려져 있지만,[49] 몽골리안 저빌 망막에서 칼슘결합단백질의 기능은 명확히 알려져 있지 않다. 칼슘 매개 신호 전달에 중요한 역할을 하는 칼슘결합단백질의 발현패턴을 콜린성 무축삭세포에서 연구하고 다른 동물과의 차이를 비교 분석을 통해 동물 다양성 이해를 증진하고자 하였다.
대상 및 방법
1. 대상 및 망막 조직 준비
본 연구는 열 마리의 몽골리안 저빌(생후 3개월 이상, 70~90 g)을 대상으로 실험하였다. 먼저 isoflurane(5% 산소)으로 마취하고, 안구를 적출한 후에 isoflurane(5% 산소) 마취제를 사용하여 안락사 하였다. 적출한 안구는 해부현미경 상에서 망막을 분리하여 4% paraformaldehyde(0.1M phosphate buffer, pH 7.4)에 2시간 동안 고정시킨 후, 0.1M phosphate buffer(pH 7.4)로 10분 간격으로 3회 세척을 한 이후 표준면역세포화학법을 실시하였다.
이 모든 실험과정은 경북대학교 동물실험윤리위원회의 승인을 받아 진행하였다(permission NO. 2021-0072).
2. 표준면역세포화학법
몽골리안 저빌 망막 내 신경전달물질을 가진 세포를 표지하기 위하여 1차 항체로 choline acetyltransferase(ChAT)는 goat anti-ChAT antibody(1:200; Millipore, Bedford, MA, USA)를, calbindin-D28K는 rabbit anti-calbindin-D28K antibody(1:200; Sigma Aldrich Co, St Louis, MO, USA.)를, calretinin은 rabbit anti-calretinin antibody(1:200; Chemicon International Inc., Temecula, CA, USA), parvalbumin은 rabbit anti-parvalbumin antibody(1:200; Swant Inc. Switzerland)를 사용하였다.
망막 수직 단면을 관찰하기 위해 4% agarose gel을 사용하여 망막을 고정시킨 후 vibratome(Vibratome 3000, The Vibratome Company, St. Louis, MO, USA)을 이용하여 50 μm 두께로 수직 절편하고 표준면역세포화학법을 실시하였다. 온조직표본은 항체, 용액의 투과성을 높이기 위해 1% sodium borohydride(NaBH4) 처리를 하였다. 그리고 10분 간격으로 0.1 M phosphate buffer(pH 7.4)를 사용하여 3번의 세척 후 blocking 하였고 다시 3번의 세척을 실시하였다. 그 후, 1차 항체는 4°C에서 약 3일 동안 incubation하였다. 그 후, 0.1M phosphate buffer(pH 7.4)로 10분 간격으로 3번 세척하였다. 2차 항체로 ChAT는 Cy3-conjugated donkey anti-goat IgG antibody(1:200; Jackson ImmunoResearch Laboratories, West Grove, PA, USA)를 사용하였고, 칼슘결합단백질은 fluorescein(FITC)- conjugated anti-mouse(1:200; Jackson ImmunoResearch Laboratories)로 염색하였다. 2차 항체도 4°C에서 약 하루 동안 처리하였다. 그리고 앞서 했던 방법으로 세척하고 슬라이드 글라스에 조직을 올려 vectashield mounting medium(Vector Laboratories)으로 커버슬립 하였다. 수직 절편은 1차 항체로 25°C에서 약 이틀, 2차 항체로 25°C에서 약 2시간 동안 처리한 후 커버슬립 하였다.
표준면역세포화학을 통해 최종적으로 염색된 조직은 Zeiss Axioplan(Carl Zeiss Meditec Inc., Jena, Germany)과 공초점 현미경(LSM 800, Carl Zeiss)을 통하여 분석되었다. 위와 같은 표준면역세포화학법에 대한 절차 및 방법은 본 연구진의 이전 연구논문에 자세히 기재되어 있다.[12,50,51]
3. 정량 분석
표준면역세포화학법으로 염색한 몽골리안 저빌 온조직 표본 망막의 신경절세포층과 속핵층에서 ChAT-IR 밀도를 분석하였다. Zeiss Plan-Apochromat ×40 대물렌즈(Carl Zeiss)를 사용하여 시신경중심에서 300 μm 떨어진 위치부터 400 μm 간격으로 200×200 μm2 면적당 세포의 수를 계산하였다. 네 방향(dorsal, nasal, ventral, temporal)에서 같은 위치의 신경절세포층과 속핵층 모두 ChAT-IR(choline acetyltransferase-immunoreactive)세포를 분석하였다. 세 동물의 망막에서 총 168개의 샘플 영역을 분석하였다. 세포밀도는 각 층의 ChAT-IR 세포 수/mm2로 표현하였다.
결 과
1. ChAT-IR 세포의 분포
몽골리안 저빌 망막에서 콜린성 무축삭세포(성화상 무축삭세포)를 보기 위해 ChAT를 염색하여 온조직표본에서 ChAT-IR 세포 분포를 확인한 결과 망막 중심부(Fig. 1A, C)에서 망막 주변부(Fig. 1B, D)보다 많은 ChAT-IR 세포들이 분포하고 있는 것을 확인하였다(Fig. 1A~D). Fig. 1E는 50 μm 두께로 수직 절편한 몽골리안 저빌 망막 조직의 단면으로 4’,6-diamidino-2-phenylindole(DAPI)에 의해서 염색된 전체 망막세포들과 Cy3로 염색된 적색의 ChAT-IR 세포가 신경절세포층과 속핵층에서 존재하고 있음을 확인하였다. ChAT-IR 세포의 수지상돌기들이 내망상층 내에서 두 개의 별개의 밴드를 형성하는 것을 볼 수 있다(IPL; Fig. 1E).
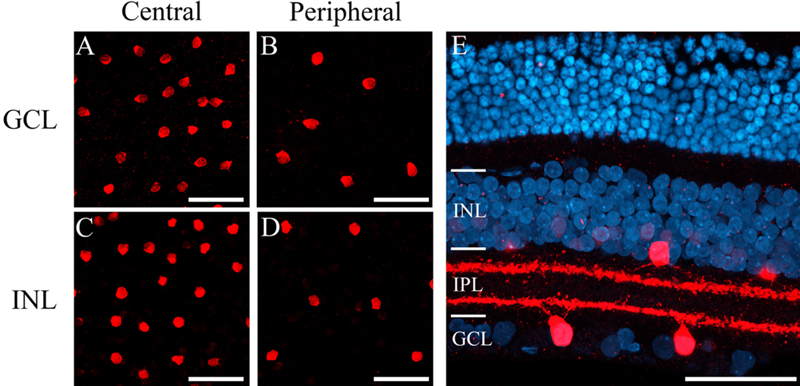
Micrographs from whole mounts and vibratome-sectioned gerbil retina labeled with anti-ChAT antibody (Cy3, red). (A) ChAT-IR neurons in the central part of the GCL of the whole mount. (B) ChAT-IR neurons in the peripheral part of the GCL of the whole mount. (C) ChAT-IR neurons in the central part of the INL of the whole mount. (D) ChAT-IR neurons in the peripheral part of the INL of the whole mount. (E) Merged ChAT-IR cells (Cy3, red) and DAPI staining (blue) Mongolian gerbil retina in a 50 μm thick vertical section. Two narrow dendritic strata were labeled in the IPL. ChAT, choline acetyltransferase; IR, immunoreactive; GCL, ganglion cell layer; INL, inner nuclear layer; IPL, inner plexiform layer. Scale bar = 50 μm
몽골리안 저빌 온조직표본 3개의 망막에서 ChAT-IR 세포의 분포도를 정량적으로 분석하였다(Fig. 2). 시신경유두를 중심으로 등쪽(dorsal), 배쪽(ventral), 귀쪽(temporal), 코쪽(nasal)의 네 방향으로 300 μm 떨어진 지점부터 400 μm 간격으로 200×200 μm2 면적의 각각 7개 구역(총 28구역)에서 ChAT-IR 세포 수를 세었고, 3개 망막에서 각 구역의 ChAT-IR 세포의 평균 밀도를 그래프로 나타내었다. ChAT-IR 세포 분포는 속핵층의 평균 밀도 분포가 신경절세포층의 평균 밀도보다 높았다(Fig. 2). 망막의 수평축과 수직축을 따라 세포밀도를 측정한 결과 신경절세포층에서 최고 밀도는 시신경유두 중심에서 코쪽으로 약 0.7 mm 떨어진 지점에서 보였으며(1,708±118 cells/mm2, 평균±표준편차; n=3), 최저 밀도는 코쪽으로 약 2.7 mm 떨어진 지점에서 보였다(817±123 cells/mm2, 평균±표준편차; n=3). 속핵층에서 최고 밀도는 시신경유두 중심에서 배쪽으로 약 0.7 mm 떨어진 지점에서 보였으며(2,083±326 cells/mm2, 평균±표준편차; n=3), 최저 밀도는 등쪽으로 약 2.7 mm 떨어진 지점에서 보였다(958±180 cells/mm2, 평균±표준편차; n=3). 이후 주변부로 갈수록 밀도가 낮아지는 것을 알 수 있다. 신경절세포층과 속핵층 모두에서 중심부에 세포의 밀도가 높고 주변으로 갈수록 낮아지는 현상을 보였다. 전체 망막에서 추정되는 ChAT-IR 평균 밀도는 신경절세포층에서 1,242±111 cells/mm2(평균±표준편차; n=3)이고 속핵층에서 1,487±257 cells/mm2(평균±표준편차; n=3)이었다.
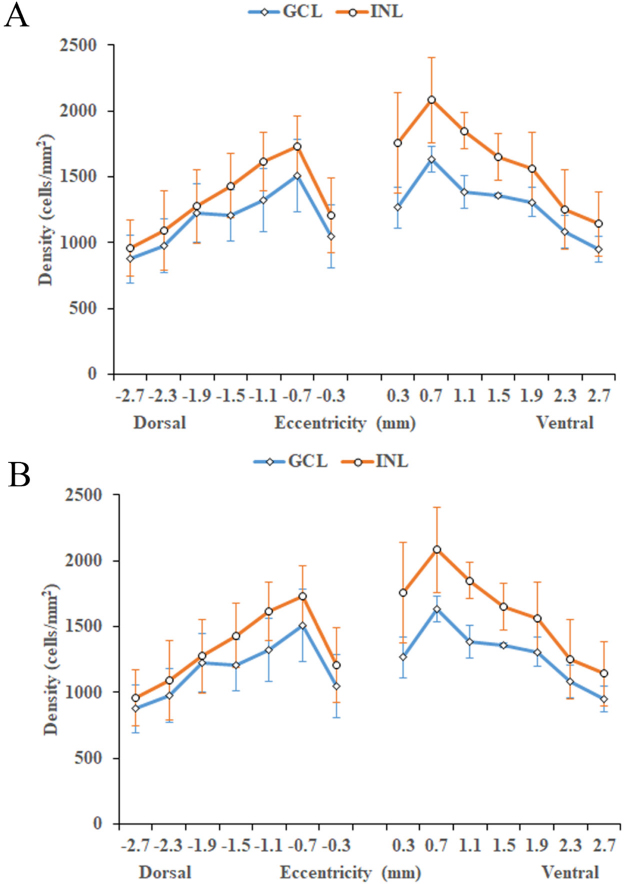
Mean density of the ChAT-IR cell distribution in the whole mount Mongolian gerbil retina of three animals. (A) The mean density of dorsal and ventral ChAT-IR cell distribution in the whole mount. (B) The mean density of nasal and temporal ChAT-IR cell distribution in the whole mount. ChAT, choline acetyltransferase; IR, immunoreactive; GCL, ganglion cell layer; INL, inner nuclear layer.
2. ChAT-IR 세포 및 칼슘결합단백질-IR 세포의면역세포 화학적 동정
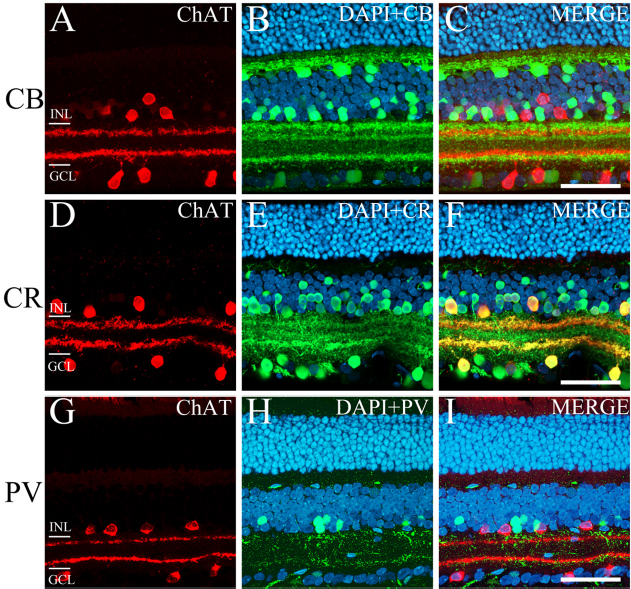
몽골리안 저빌 망막에서 칼슘결합단백질과 ChAT-IR 세포와 colocalize되는지 확인하기 위해 표준면역세포화학법을 사용해 온조직표본 망막에 FITC로 calbindin-D28K, calretinin, 그리고 parvalbumin을, Cy3로 ChAT를 이중 표지(double labeling)하여 confocal image로 나타내었다(Fig 3). Fig. 3에서 볼 수 있는 것처럼, 몽골리안 저빌 망막에서 calbindin-D28K와 parvalbumin은 ChAT-IR 세포와 colocalization되지 않았다(Fig. 3A~F, M~R). 반면 calretinin은 ChAT-IR 세포와 모두 colocalization되는 것을 확인할 수 있다(Fig. 3G~L).

Confocal images of the immunocytochemical localization of ChAT and calcium-binding protein-IR cells in the Mongolian gerbil retina. ChAT-IR cells (Cy3, red; A, D, G, J, M, P) and calcium-binding protein-IR cells (FITC, green; B, E, H, K, N, Q) by double-labeling FITC in whole mount. (A) ChAT-IR cells in the ganglion cell layer. (B) CB-IR cells in the GCL. (C) Merged ChAT-IR cells and CB-IR cells in the GCL. (D) ChAT-IR cells in the INL. (E) CB-IR cells in the INL. (F) Merged ChAT-IR cells and CB-IR cells in the INL. (G) ChAT-IR cells in the GCL. (H) CR-IR cells in the GCL. (I) Merged ChAT-IR cells and CR-IR cells in the GCL. (J) ChAT-IR cells in the INL. (K) CR-IR cells in the INL. (L) Merged ChAT-IR cells and CR-IR cells in the INL. (M) ChAT-IR cells in the GCL. (N) PV-IR cells in the GCL. (O) Merged ChAT-IR and PV-IR cells in the GCL. (P) ChAT-IR cells in the INL. (Q) PV-IR cells in the INL. (R) Merged ChAT-IR cells and PV-IR cells in the INL. ChAT, choline acetyltransferase; IR, immunoreactive; CB, calbindin-D28K; CR, calretinin; PV, parvalbumin; GCL, ganglion cell layer; INL, inner nuclear layer. Scale bar = 50 μm.
수직 절편한 망막 조직에서 표준면역세포화학법을 시행하여 ChAT-IR 세포는 Cy3로 적색으로 염색이 되었고, calcium-binding protein-IR 세포는 FITC로 녹색으로 염색하여 confocal image로 확인한 결과 온조직표본에서 나타난 염색 양상과 동일하였다(Fig. 4). Fig. 4A, D, G는 Cy3로 염색된 ChAT-IR 세포이다. Fig. 4B, E, H에서 청색은 DAPI로 염색된 핵을 나타낸다. Fig. 4B에서 녹색은 FITC로 염색된 calbindin-D28K-IR 세포를 나타내고, Fig. 4E에서 녹색은 FITC로 염색된 calretinin-IR 세포를 나타내고, Fig. 4H에서 녹색은 FITC로 염색된 parvalbumin-IR 세포를 나타낸다. Fig. 4C는 DAPI와 calbindin-D28K-IR 세포, ChAT-IR 세포를 합친 것이다. Fig. 4F는 DAPI와 calretinin-IR 세포, ChAT-IR 세포를 합친 것이다. Fig. 4I는 DAPI와 parvalbumin-IR 세포, ChAT-IR 세포를 합친 것이다. 신경절세포층과 속핵층 모두 calretinin과 ChAT-IR 세포와 모두 colocalization되었으나(Fig. 4D~F), calbindin-D28K과 parvalbumin에선 모두 colocalization되지 않았다(Fig. 4A~C, G~I).
Tissues obtained by vertical sectioning of Mongolian gerbil retina at a thickness of 50 μm were stained: ChAT-IR cells (Cy3, red), calcium-binding protein-IR cells (FITC, green), and DAPI (blue). (A) ChAT-IR cells. (B) Merged image of DAPI (blue) and CB-IR cells (green). (C) Merged image of ChAT-IR cells (red), DAPI (blue), and CB-IR cells (green). Merged images of ChAT and CB immunoreactivity in the GCL and INL show that ChAT-IR was not colocalized with CB-IR cells. (D) ChAT-IR cells. (E) Merged image of DAPI (blue) and CR-IR cells. (F) Merged image of ChAT-IR cells (red), DAPI (blue), and CR-IR cells. Merged ChAT and CR images immunoreactivity in the GCL and INL show ChAT-IR cells colocalized with CR-IR cells. (G) ChAT-IR cells. (H) Merged image of DAPI and PV-IR cells. (I) Merged image of ChAT-IR cells, DAPI, and PV-IR cells. Merged images of ChAT and PV immunoreactivity in the GCL and INL show ChAT-IR cells not colocalized with PV-IR cells. ChAT, choline acetyltransferase; IR, immunoreactive; CB, calbindin-D28K; CR, calretinin; PV, parvalbumin; GCL, ganglion cell layer; INL, inner nuclear layer. Scale bar = 50 μm.
고 찰
본 연구에서는 사육하기 용이하며 낮과 밤에 활동적인 특성으로 실험동물모델로 많이 사용되고 있는 몽골리안저빌을 이용하여 콜린성 무축삭세포의 분포 양상에 대한 실험을 수행하였다.
몽골리안 저빌 망막의 콜린성 무축삭세포는 망막 중심부에서 높은 밀도를 나타내었고, 주변부로 갈수록 세포의 밀도가 줄어드는 것을 확인하였다. 이 결과는 이전에 보고된 다른 포유류의 결과와 일치한다.[8,12,13,16,18,52] 이전 연구에 의하면 닭,[52] 생쥐,[12] 쥐,[13] 박쥐,[25] 토끼,[53] 망막에서 콜린성 무축삭세포의 밀도는 망막 중심부에서 더 높았고 주변부 망막에서 더 낮았다. 이들 중 닭,[52] 생쥐,[12] 박쥐,[25] 망막에서 콜린성 무축삭세포의 밀도는 신경절세포층보다 속핵층에서 더 높았다. 대조적으로 쥐,[13] 나무두더지,[54] 고양이[16] 망막에서 콜린성 무축삭세포의 밀도는 속핵층보다 신경절세포층에서 더 높았다. 이러한 연구의 결과들은 몽골리안 저빌에서 콜린성 무축삭세포의 망막의 층별 분포에 있어서는 닭, 생쥐, 박쥐 등과 비슷하나 쥐, 나무두더지, 고양이 등과는 다름을 보여주면서 동물마다 콜린성 무축삭세포의 분포에 있어서 다양성이 있음을 시사하고 있다.
생쥐 망막에서 콜린성 무축삭세포의 평균 밀도는 신경절 세포층에서 945 cells/mm2, 속핵층에서 1,100 cells/mm2이었다.[12] 박쥐 망막의 콜린성 무축삭세포의 평균 밀도는 신경절세포층에서 약 260 cells/mm2, 속핵층에서 530 cells/mm2이었다.[20] 상어 망막에서 신경절세포층과 속핵층의 콜린성 무축삭세포의 밀도가 약 300 cells/mm2 으로 비슷한 밀도를 나타냈다.[55] 쥐 망막의 콜린성 무축삭세포의 평균밀도는 신경절세포층에서 약 520 cells/mm2, 속핵층에서 500 cells/mm2로,[13] 다른 동물의 망막에서와는 달리 신경절세포층의 콜린성 무축삭세포가 속핵층보다 더 많은 것으로 나타났다. 고양이,[16] 거북이[10]에서 콜린성 무축삭세포의 약 60%는 신경절세포층에 있었고, 원숭이[18]의 경우 콜린성 무축삭세포의 약 70%가 신경절세포층에 있었다. 동물마다 신경절세포층과 속핵층 사이의 콜린성 무축삭세포 분포의 기능적 중요성과 관련된 연구는 미흡하지만, 이러한 밀도의 차이는 속핵층의 콜린성 무축삭세포가 신경절세포층의 콜린성 무축삭세포보다 더 많은 기능을 할 수 있다는 견해를 뒷받침할 수 있다.
몽골리안 저빌의 망막에서 calbindin-D28K와 parvalbumin은 콜린성 무축삭세포와 colocalization되지 않는 반면, calretinin은 콜린성 무축삭세포와 모두 colocalization되는 것을 확인할 수 있다. 쥐의 망막에서 콜린성 무축삭세포는 calbindin-D28K와 parvalbumin은 colocalization되지 않지만, calretinin과는 colocalization되었다.[13] 땅다람쥐에서 콜린성 무축삭세포는 calbindin-D28K와 calretinin 그리고 parvalbumin에서 colocalization되었다.[15] 하지만 박쥐 망막에서 콜린성 무축삭세포는 calbindin-D28K와 colocalization 되었지만, calretinin과 parvalbumin에선 colocalization되지 않았다.[25] 또한 토끼 망막에서 콜린성 무축삭세포는 parvalbumin에서만 colocalization된 반면,[4] 사람과 마모셋 망막에서 신경절세포층의 콜린성 무축삭세포는 calbindin-D28K와 colocalization하고 속핵층의 일부 콜린성 무축삭세포도 calbindin-D28K와 colocalization한다.[56] 이는 calretinin만이 ChAT와 colocalization되는 몽골리안 저빌의 경우와 다르다는 것을 확인할 수 있다. 이러한 결과는 콜린성 무축삭세포에서 칼슘결합단백질의 발현이 동물 종에 따라 다를 수 있다는 것을 보여준다.
칼슘결합단백질은 중추 신경계에서 칼슘과 결합하여 칼슘 매개 신호 전달에 중요한 역할을 하는 것으로 생각된다.[4,25,29,57,58] 칼슘 이온은 신경 작용에 관여하고 칼슘결합단백질은 칼슘의 기능을 조절하며,[28] 이들 단백질은 세포의 항상성과 신경보호 기능을 유지하기 위해 세포 내 칼슘 농도를 완충시키는 역할을 하는 것으로 여겨진다.[29,57] 비록 이러한 칼슘결합단백질의 진정한 기능은 아직 알려지지 않았지만 칼슘결합단백질의 현재까지 연구된 모든 망막에서의 존재는 망막 세포의 시각 기능에서 잠재적으로 아주 중요하다는 것을 시사하고 있다.[28,29,57-59] 칼슘 결합 단백질 중에서 calbindin-D28K는 쥐의 망막에서 허혈 손상에 대한 보호 기능을 가질 수 있음이 보고된 바 있다.[48] calretinin은 활동 전위에도 관여한다. 또한 시각계에서 축삭의 재생 과정에서 중요한 역할을 하는 것으로 알려져 있고,[60] 인간 망막 뉴런의 발달과 성숙에도 중요한 역할을 하는 것으로 보고되었다.[49] 망막에서 parvalbumin의 기능은 잘 알려진 바가 없지만 당뇨성 망막[61] 및 녹내장 망막[62] 신경세포에서 parvalbumin의 발현이 감소되는 연구들의 결과가 parvalbumin이 이러한 질병들과 밀접한 관계가 있음을 나타내고 있다.[62] 또한 시신경 손상 후의 parvalbumin의 정상적인 발현을 유지하는 것은 신경절세포의 생존을 향상시키는 것으로 나타났다.[63] calbindin-D28K 및 calretinin의 경우 연령과 관련해 1차 시각 피질에서 감소되었다.[64] 하지만 알츠하이머 환자의 시각 피질에서 calbindin-D28K-, calretinin- 및 parvalbumin-IR 세포의 유의한 감소는 없었고,[65] 정신분열증 환자의 대뇌피질에서 calretinin-IR 세포는 감소하지 않았다.[66] 그러나 calbindin-D28K- 및 parvalbumin-IR 세포의 선택적 손실은 정신분열증에서 발견 되었다.[66] 또한, 시각 피질에서 calbindin-D28K-IR GABA성 뉴런의 밀도 감소는 주요 우울증과 관련이 있다.[67]
콜린성 무축삭세포는 사이신경세포로 신경 전달 물질인 GABA와 아세틸콜린을 모두 방출하는 특이성을 가지고 있다. 뇌에서 다양한 GABA성 사이신경세포들은 칼슘결합단백질로 calbindin-D28K, calretinin 또는 parvalbumin을 포함하는지 여부에 따라 다양한 하위 집단으로 나눌 수 있는데,[68] 본 연구에서의 ChAT-IR에서 특정 칼슘결합단백질의 발현의 결과로 우리는 GABA성 사이신경세포의 하위집단이 종에 따라 매우 다르다는 결론을 내릴 수 있다. 콜린성에서 calbindin-D28K, calretinin 및 parvalbumin의 정확한 생리적 기능은 여전히 불분명하지만, 몽골리안저빌의 경우에 있어서 유일하게 calretinin만이 콜린성 무축삭세포에서 발현된다는 것은 calretinin의 특이한 역할이 콜린성 무축삭세포에 있음을 시사하고 있다.
이전의 생쥐에서의 연구에 의하면 콜린성 무축삭세포가 속핵층의 모든 무축삭세포의 약 3%, 신경절세포층의 모든 무축삭세포의 약 19.5%를 구성하며, 전체 망막의 무축삭세포 중 5.2%를 차지하는 것으로 나타났다.[12] 이러한 사실은 콜린성 무축삭세포가 망막 기능에서 중요한 역할을 한다는 것을 의미한다. 특별히 생물의 생존에 필수적인 동작감지를 위한 망막 신경절세포의 방향 선택성의 주요 메커니즘은 콜린성 무축삭세포에 의해 강력하게 매개하는 것으로 알려져 있으며, 방향 선택성은 성화상 무축삭세포에서 방향특이성 신경절세포로의 해부학적으로 대칭인 콜린성 및 비대칭 GABA성 시냅스 연결성을 포함한다.[21,24,69,70] 즉, 성화상 무축삭세포에서 분비되어지는 아세틸콜린은 방향 정보에 대한 미세 회로의 기능 계산에서 흥분성 신경전달의 중요한 역할을 하는 것으로 알려져 있다.[69] 하지만 망막에서 콜린성 무축삭세포의 기능은 여전히 알려져 있지 않은 부분이 많이 있어 보다 많은 연구가 앞으로 필요하다.
결 론
본 연구에서는 몽골리안 저빌 망막에서 콜린성 무축삭세포에서 면역세포화학적인 분석을 통해 칼슘결합단백질의 면역반응성을 확인하였다. ChAT-IR 세포 분포에서 주변부보다 중심부에서 높은 밀도를 확인하였고, 신경절세포층보다 속핵층에서 ChAT-IR 세포의 높은 밀도를 확인 할 수 있었다. 또한, 몽골리안 저빌 망막에서 calbindin-D28K와 parvalbumin은 ChAT-IR 세포와 colocalization 되지 않았지만 calretinin은 ChAT-IR 세포와 모두 colocalization되는 것을 확인할 수 있었다. 이 결과로 보아, 몽골리안 저빌 망막에서 calretinin이 콜린성 무축삭세포에서 칼슘 완충 단백질로 작용하는 것으로 생각된다. 실험 동물로 가장 많이 사용되어온 생쥐 및 쥐와는 달리 주행성 동물로써 중추시각계 연구에 있어서 좋은 모델 동물이 될 수 있는 몽골리안 저빌 망막에서 콜린성 무축삭세포의 분포와 이들 세포에서의 특정 칼슘결합단백질의 발현 연구는 몽골리안 저빌의 시각 시스템에 대한 더 나은 정보를 제공하며, 앞으로 주행성 동물의 시각기능을 이해하기 위한 더 깊은 연구에 도움이 될 것으로 사료된다.
Acknowledgments
본 연구는 2022학년도 경북대학교 연구년 교수 연구비에 의하여 연구되었습니다.
References
-
Masland RH. Neuronal cell types. Curr Biol. 2004;14(13):497-500.
[https://doi.org/10.1016/j.cub.2004.06.035]

-
Balasubramanian R, Gan L. Development of retinal amacrine cells and their dendritic stratification. Curr Ophthalmol Rep. 2014;2(3):100-106.
[https://doi.org/10.1007/s40135-014-0048-2]

-
Ray TA, Roy S, Kozlowski C, et al. Formation of retinal direction-selective circuitry initiated by starburst amacrine cell homotypic contact. Elife. 2018;7:e34241.
[https://doi.org/10.7554/eLife.34241]

-
Lee ES, Jeon CJ. Starburst amacrine cells express parvalbumin but not calbindin and calretinin in rabbit retina. Neuroreport. 2013;24(16):918-923.
[https://doi.org/10.1097/wnr.0000000000000026]

-
Zhou ZJ. Direct participation of starburst amacrine cells in spontaneous rhythmic activities in the developing mammalian retina. J Neurosci. 1998;18(11):4155-4165.
[https://doi.org/10.1523/jneurosci.18-11-04155.1998]

-
Zheng JJ, Lee S, Zhou ZJ. A developmental switch in the excitability and function of the starburst network in the mammalian retina. Neuron. 2004;44(5):851-864.
[https://doi.org/10.1016/j.neuron.2004.11.015]

-
Masland RH. The many roles of starburst amacrine cells. Trends Neurosci. 2005;28(8):395-396.
[https://doi.org/10.1016/j.tins.2005.06.002]

-
Famiglietti EV, Tumosa N. Immunocytochemical staining of cholinergic amacrine cells in rabbit retina. Brain Res. 1987;413(2):398-403.
[https://doi.org/10.1016/0006-8993(87)91037-7]

-
Famiglietti EV Jr. 'Starburst' amacrine cells and cholinergic neurons: mirror-symmetric on and off amacrine cells of rabbit retina. Brain Res. 1983;261(1):138-144.
[https://doi.org/10.1016/0006-8993(83)91293-3]

-
Nguyen LT, De Juan J, Mejia M, et al. Localization of choline acetyltransferase in the developing and adult turtle retinas. J Comp Neurol. 2000;420(4):512-526.
[https://doi.org/10.1002/(sici)1096-9861(20000515)420:4<512::aid-cne8>3.0.co;2-0]

-
Kang TH, Ryu YH, Kim IB, et al. Comparative study of cholinergic cells in retinas of various mouse strains. Cell Tissue Res. 2004;317(2):109-115.
[https://doi.org/10.1007/s00441-004-0907-5]

-
Jeon CJ, Strettoi E, Masland RH. The major cell populations of the mouse retina. J Neurosci. 1998;18(21):8936-8946.
[https://doi.org/10.1523/jneurosci.18-21-08936.1998]

-
Voigt T. Cholinergic amacrine cells in the rat retina. J Comp Neurol. 1986;248(1):19-35.
[https://doi.org/10.1002/cne.902480103]

-
Gábriel R, Witkovsky P. Cholinergic, but not the rod pathway- related glycinergic (All), amacrine cells contain calretinin in the rat retina. Neurosci Lett. 1998;247(2-3):179-182.
[https://doi.org/10.1016/s0304-3940(98)00323-1]

-
Cuenca N, Deng P, Linberg KA, et al. The neurons of the ground squirrel retina as revealed by immunostains for calcium binding proteins and neurotransmitters. J Neurocytol. 2002;31(8-9):649-666.
[https://doi.org/10.1023/a:1025791512555]

-
Schmidt M, Wässle H, Humphrey M. Number and distribution of putative cholinergic neurons in the cat retina. Neurosci Lett. 1985;59(3):235-240.
[https://doi.org/10.1016/0304-3940(85)90137-5]

-
Moritoh S, Komatsu Y, Yamamori T, et al. Diversity of retinal ganglion cells identified by transient GFP transfection in organotypic tissue culture of adult marmoset monkey retina. PLoS One. 2013;8(1):e54667.
[https://doi.org/10.1371/journal.pone.0054667]

-
Rodieck RW, Marshak DW. Spatial density and distribution of choline acetyltransferase immunoreactive cells in human, macaque, and baboon retinas. J Comp Neurol. 1992;321(1):46-64.
[https://doi.org/10.1002/cne.903210106]

-
Barlow HB, Levick WR. The mechanism of directionally selective units in rabbit's retina. J Physiol. 1965;178(3):477-504.
[https://doi.org/10.1113/jphysiol.1965.sp007638]

-
Lee JS, Kim HJ, Ahn CH, et al. Expression of nicotinic acetylcholine receptor α4 and β2 subunits on directions-elective retinal ganglion cells in the rabbit. Acta Histochem Cytochem. 2017;50(1):29-37.
[https://doi.org/10.1267/ahc.16024]

-
Amthor FR, Oyster CW, Takahashi ES. Morphology of on-off direction-selective ganglion cells in the rabbit retina. Brain Res. 1984;298(1):187-190.
[https://doi.org/10.1016/0006-8993(84)91167-3]

-
Taylor WR, Smith RG. The role of starburst amacrine cells in visual signal processing. Vis Neurosci. 2012;29(1):73-81.
[https://doi.org/10.1017/s0952523811000393]

-
Masland RH. The neuronal organization of the retina. Neuron. 2012;76(2):266-280.
[https://doi.org/10.1016/j.neuron.2012.10.002]

-
Euler T, Detwiler PB, Denk W. Directionally selective calcium signals in dendrites of starburst amacrine cells. Nature. 2002;418(6900):845-852.
[https://doi.org/10.1038/nature00931]

-
Park EB, Gu YN, Jeon CJ. Immunocytochemical localization of cholinergic amacrine cells in the bat retina. Acta Histochem. 2017;119(4):428-437.
[https://doi.org/10.1016/j.acthis.2017.04.009]

-
Lee S, Kim K, Zhou ZJ. Role of ACh-GABA cotransmission in detecting image motion and motion direction. Neuron. 2010;68(6):1159-1172.
[https://doi.org/10.1016/j.neuron.2010.11.031]

-
Yoshida K, Watanabe D, Ishikane H, et al. A key role of starburst amacrine cells in originating retinal directional selectivity and optokinetic eye movement. Neuron. 2001;30(3):771-780.
[https://doi.org/10.1016/s0896-6273(01)00316-6]

-
Schäfer BW, Heizmann CW. The S100 family of EF-hand calcium-binding proteins: functions and pathology. Trends Biochem Sci. 1996;21(4):134-140.
[https://doi.org/10.1016/s0968-0004(96)80167-8]

-
Baimbridge KG, Celio MR, Rogers JH. Calcium-binding proteins in the nervous system. Trends Neurosci. 1992;15(8):303-308.
[https://doi.org/10.1016/0166-2236(92)90081-i]

- Druga R. Neocortical inhibitory system. Folia Biol (Praha). 2009;55(6):201-217.
-
Qi Y, Cheng H, Wang Y, et al. Revealing the precise role of calretinin neurons in epilepsy: we are on the way. Neurosci Bull. 2022;38(2):209-222.
[https://doi.org/10.1007/s12264-021-00753-1]

-
Reynolds GP, Abdul-Monim Z, Neill JC, et al. Calcium binding protein markers of GABA deficits in schizophrenia-post mortem studies and animal models. Neurotox Res. 2004;6(1):57-61.
[https://doi.org/10.1007/bf03033297]

-
Deng P, Cuenca N, Doerr T, et al. Localization of neurotransmitters and calcium binding proteins to neurons of salamander and mudpuppy retinas. Vison Res. 2001;41(14):1771-1783.
[https://doi.org/10.1016/s0042-6989(01)00060-8]

-
Wässle H, Peichl L, Airaksinen MS, et al. Calcium-binding proteins in the retina of a calbindin-null mutant mouse. Cell Tissue Res. 1998;292(2):211-218.
[https://doi.org/10.1007/s004410051052]

-
Hwang IK, Yoo KY, Kim DS, et al. Comparative study on calretinin immunoreactivity in gerbil and rat retina. Anat Histol Embryol. 2005;34(2):129-131.
[https://doi.org/10.1111/j.1439-0264.2004.00583.x]

-
Uesugi R, Yamada M, Mizuguchi M, et al. Calbindin D-28k and parvalbumin immunohistochemistry in developing rat retina. Exp Eye Res. 1992;54(4):491-499.
[https://doi.org/10.1016/0014-4835(92)90127-e]

-
Hamano K, Kiyama H, Emson PC, et al. Localization of two calcium binding proteins, calbindin (28 kD) and parvalbumin (12 kD), in the vertebrate retina. J Comp Neurol. 1990;302(2):417-424.
[https://doi.org/10.1002/cne.903020217]

-
Massey SC, Mills SL. A calbindin-immunoreactive cone bipolar cell type in the rabbit retina. J Comp Neurol. 1996;366(1):15-33.
[https://doi.org/10.1002/(sici)1096-9861(19960226)366:1<15::Aid-cne2>3.0.Co;2-n]

-
Jeon MH, Jeon CJ. Immunocytochemical localization of calretinin containing neurons in retina from rabbit, cat, and dog. Neurosci Res. 1998;32(1):75-84.
[https://doi.org/10.1016/s0168-0102(98)00070-4]

- Kwon OJ, Kim JY, Kim SY, et al. Alterations in the localization of calbindin D28K-, calretinin-, and parvalbumin-immunoreactive neurons of rabbit retinal ganglion cell layer from ischemia and reperfusion. Mol Cells. 2005;19(3):382-390.
-
Macharadze T, Budinger E, Brosch M, et al. Early sensory loss alters the dendritic branching and spine density of supragranular pyramidal neurons in rodent primary sensory cortices. Front Neural Circuits. 2019;13:61.
[https://doi.org/10.3389/fncir.2019.00061]

-
Govardovskii VI, Röhlich P, Szél A, et al. Cones in the retina of the Mongolian gerbil, Meriones unguiculatus: an immunocytochemical and electrophysiological study. Vison Res. 1992;32(1):19-27.
[https://doi.org/10.1016/0042-6989(92)90108-u]

-
Garcia Garrido M, Beck SC, Mühlfriedel R, et al. Towards a quantitative OCT image analysis. PLoS One. 2014;9(6):e100080.
[https://doi.org/10.1371/journal.pone.0100080]

-
Huber G, Heynen S, Imsand C, et al. Novel rodent models for macular research. PLoS One. 2010;5(10):e13403.
[https://doi.org/10.1371/journal.pone.0013403]

-
Luan L, Ren C, Lau BWM, et al. Y-like retinal ganglion cells innervate the dorsal raphe nucleus in the Mongolian gerbil (Meriones unguiculatus). PLoS One. 2011;6(4):e18938.
[https://doi.org/10.1371/journal.pone.0018938]

-
Luan L, Ren C, Wang W, et al. Morphological properties of medial amygdala-projecting retinal ganglion cells in the Mongolian gerbil. Sci China Life Sci. 2018;61(6):644-650.
[https://doi.org/10.1007/s11427-017-9275-6]

-
Bytyqi AH, Layer PG. Lamina formation in the Mongolian gerbil retina (Meriones unguiculatus). Anat Embryol (Berl). 2005;209(3):217-225.
[https://doi.org/10.1007/s00429-004-0443-9]

- Kim S, Cha J, Jeon J, et al. Calbindin D28k is sole calcium binding protein with neuroprotective function against pressure-induced retinal ischemia-reperfusion in rats. Invest Ophthalmol Vis Sci. 2009;50(13):123.
-
Nag TC, Wadhwa S. Developmental expression of calretinin immunoreactivity in the human retina and a comparison with two other EF-hand calcium binding proteins. Neuroscience. 1999;91(1):41-50.
[https://doi.org/10.1016/s0306-4522(98)00654-x]

-
Gu YN, Kim HG, Jeon CJ. Localization of nitric oxide synthase-containing neurons in the bat visual cortex and co-localization with calcium-binding proteins. Acta Histochem Cytochem. 2015;48(4):125-133.
[https://doi.org/10.1267/ahc.14066]

-
Yu SH, Lee JY, Jeon CJ. Immunocytochemical localization of calcium-binding proteins, calbindin D28K-, calretinin-, and parvalbumin-containing neurons in the dog visual cortex. Zool Sci. 2011;28(9):694-702.
[https://doi.org/10.2108/zsj.28.694]

-
Millar TJ, Ishimoto I, Chubb IW, et al. Cholinergic amacrine cells of the chicken retina: a light and electron microscope immunocytochemical study. Neuroscience. 1987;21(3):725-743.
[https://doi.org/10.1016/0306-4522(87)90033-9]

-
Strettoi E, Masland RH. The number of unidentified amacrine cells in the mammalian retina. Proc Natl Acad Sci USA. 1996;93(25):14906-14911.
[https://doi.org/10.1073/pnas.93.25.14906]

- Sandmann D, Engelmann R, Peichl L. Starburst cholinergic amacrine cells in the tree shrew retina. J Comp Neurol. 1997;389(1):161-176.
-
Brandon C. Cholinergic amacrine neurons of the dogfish retina. Vis Neurosci. 1991;6(6):553-562.
[https://doi.org/10.1017/s0952523800002534]

-
Chandra AJ, Lee SCS, Grünert U. Melanopsin and calbindin immunoreactivity in the inner retina of humans and marmosets. Vis Neurosci. 2019;36:E009.
[https://doi.org/10.1017/s0952523819000087]

-
Rogers JH. Calretinin: a gene for a novel calcium-binding protein expressed principally in neurons. J Cell Biol. 1987;105(3):1343-1353.
[https://doi.org/10.1083/jcb.105.3.1343]

-
Polans A, Baehr W, Palczewski K. Turned on by Ca2+! The physiology and pathology of Ca(2+)-binding proteins in the retina. Trends Neurosci. 1996;19(12):547-554.
[https://doi.org/10.1016/s0166-2236(96)10059-x]

-
Altobelli GG, Van Noorden S, Cimini V. Calcium-binding protein and some neuropeptides in the retina of Octopus vulgaris: a morpho-histochemical study. J Cell Physiol. 2018;233(10):6866-6876.
[https://doi.org/10.1002/jcp.26570]

-
García-Crespo D, Vecino E. Differential expression of calretinin in the developing and regenerating zebrafish visual system. Histol Histopathol. 2004;19(4):1193-1199.
[https://doi.org/10.14670/hh-19.1193]

-
Park HS, Park SJ, Park SH, et al. Shifting of parvalbumin expression in the rat retina in experimentally induced diabetes. Acta Neuropathol. 2008;115(2):241-248.
[https://doi.org/10.1007/s00401-007-0314-6]

- Hernandez M, Rodriguez FD, Sharma SC, et al. Immunohistochemical changes in rat retinas at various time periods of elevated intraocular pressure. Mol Vis. 2009;15:2696-2709.
-
Hong CJH, Siddiqui AM, Sabljic TF, et al. Changes in parvalbumin immunoreactive retinal ganglion cells and amacrine cells after optic nerve injury. Exp Eye Res. 2016;145:363-372.
[https://doi.org/10.1016/j.exer.2015.11.005]

-
Bu J, Sathyendra V, Nagykery N, et al. Age-related changes in calbindin-D28k, calretinin, and parvalbumin-immunoreactive neurons in the human cerebral cortex. Exp Neurol. 2003;182(1):220-231.
[https://doi.org/10.1016/s0014-4886(03)00094-3]

-
Leuba G, Kraftsik R, Saini K. Quantitative distribution of parvalbumin, calretinin, and calbindin D-28k immunoreactive neurons in the visual cortex of normal and Alzheimer cases. Exp Neurol. 1998;152(2):278-291.
[https://doi.org/10.1006/exnr.1998.6838]

-
Reynolds GP, Zhang ZJ, Beasley CL. Neurochemical correlates of cortical GABAergic deficits in schizophrenia: selective losses of calcium binding protein immunoreactivity. Brain Res Bull. 2001;55(5):579-584.
[https://doi.org/10.1016/s0361-9230(01)00526-3]

-
Maciag D, Hughes J, O'Dwyer G, et al. Reduced density of calbindin immunoreactive GABAergic neurons in the occipital cortex in major depression: relevance to neuroimaging studies. Biol Psychiatry. 2010;67(5):465-470.
[https://doi.org/10.1016/j.biopsych.2009.10.027]

-
Andressen C, Blümcke I, Celio MR. Calcium-binding proteins: selective markers of nerve cells. Cell Tissue Res. 1993;271(2):181-208.
[https://doi.org/10.1007/bf00318606]

-
Briggman KL, Helmstaedter M, Denk W. Wiring specificity in the direction-selectivity circuit of the retina. Nature. 2011;471(7337):183-188.
[https://doi.org/10.1038/nature09818]

-
Fried SI, Münch TA, Werblin FS. Mechanisms and circuitry underlying directional selectivity in the retina. Nature. 2002;420(6914): 411-414.
[https://doi.org/10.1038/nature01179]

