소프트 콘택트렌즈의 재질에 따른 황색포도알균의 바이오필름 형성 및 관련 유전자 발현의 차이

초록
본 연구에서는 안질환 감염의 가장 흔한 세균인 황색포도알균을 이용하여 렌즈 재질에 따라 바이오필름 형성이 다른지 알아보았다. 또한 바이오필름 관련 유전자 발현의 차이도 알아보았다.
Etafilcon A와 hilafilcon B 재질의 렌즈에서 황색포도알균에 의한 바이오필름 형성 정도를 비교하기 위하여 XTT assay와 건조중량 측정 방법을 사용하였다. 바이오필름 형성에 관여하는 유전자들의 발현을 비교하기 위하여 역전사 PCR과 실시간 PCR을 사용하였다. 주사전자현미경을 이용하여 각 렌즈 표면의 부착된 황색포도알균을 관찰하였다.
XTT assay와 건조 중량 측정 결과 etafilcon A 재질의 렌즈에서 hilafilcon B 재질에 비해 바이오필름 형성이 유의하게 높게 나타났다. 유전자들의 발현을 비교한 결과에서는 역전사 PCR과 실시간 PCR 모두 etafilcon A 재질의 렌즈에서 hilafilcon B 재질의 렌즈에 비해 바이오필름 형성 관련 유전자의 발현이 높게 나타났으며, 실시간 PCR에서 icaA, icaB, icaC, icaD, fnbA, fnbB 유전자 발현 차이는 유의하게 나타났다. 또한 주사전자현미경으로 관찰하였을 때 etafilcon A 재질의 렌즈의 표면에서 더 많은 수의 균이 여러 층으로 부착되어 있는 것을 확인하였다.
콘택트렌즈 재질에 따라 황색포도알균의 바이오필름 형성 및 관련 유전자 발현에 차이가 있으며, 이는 콘택트렌즈의 선택과 관리에 참고해야 할 점으로 생각된다.
Abstract
In this study, we investigated whether different contact lens materials affected the ability of Staphylococcus aureus to form surface biofilm. Also, we examined the differences of biofilm-related gene expression.
XTT assay and dry weight measurement were used to compare the amounts of biofilm formation on etafilcon A and hilafilcon B lenses. Reverse transcription PCR and real time PCR were used to compare the expression level of genes related to biofilm formation. The adhered S. aureus was observed by scanning electron microscope.
The biofilm formation was higher on the surface of etafilcon A than on the surface of hilafilcon B when measured by the XTT assay and by dry weight measurement. In the comparison of gene expressions was higher on etafilcon A than on hilafilcon B, both in the reverse transcription PCR and real time PCR. In real-time PCR, gene expression of icaA, icaB, icaC, icaD, fnbA and fnbB were statistically significantly different. Observation with a scanning electron microscope confirmed that S. aureus was more prolific and formed thicker layers on the surface of etafilcon A than on the surface of hilafilcon B.
Biofilm formation and related gene expression of S. aureus was dependent on the materials of the contact lens, and this should be considered when making a choice and managing the contact lenses.
Keywords:
Biofilm, Etafilcon A, Hilafilcon B, Contact lens키워드:
바이오필름, Etafilcon A, Hilafilcon B, 콘택트렌즈서 론
최근 콘택트렌즈는 사용이 편리하여 남녀노소에 상관없이 널리 이용되고 있으며, 콘택트렌즈의 재질별로 종류도 다양해서 소비자가 본인에 맞는 제품을 고려하여 구매할 수 있는 선택의 폭이 넓다. 콘택트렌즈의 재질은 오랫동안 PMMA(polymethyl methacrylate)가 대표적이었으나 습윤성과 산소투과성이 나쁘다는 단점이 있어, 1970년대에 HEMA(hydroxyethyl methacrylate) 소재로 소프트 콘택트렌즈가 개발 된 이후로 요즘은 다양한 모노머를 중합하여 산소투과율과 착용감을 향상시킨 소프트 하이드로겔 재질의 콘택트렌즈의 사용이 늘어나고 있는 추세이다.[1,2] 그러나 이렇게 다양한 소프트 하이드로겔 콘택트렌즈 소재의 개발에도 불구하고 콘택트렌즈와 관련된 미생물 감염 질환은 지속적으로 발생하고 있다.[3-5,18] 콘택트렌즈 사용과 관련된 미생물 감염으로 미생물 각막염(microbial keratitis; MK), 콘택트렌즈 유발 급성 출혈성 결막염(contact lens related acute red eye; CLARE), 콘택트렌즈 유발 주변부 궤양(contact lens peripheral ulcer; CLPU), 침윤성 각막염(infiltrative keratitis; IK) 등이 있다. 특히 미생물 각막염의 경우 12-66%는 콘택트렌즈 사용과 관련되어 발생한다고 알려져 있으며 이는 각막에 상처를 내어 실명에 이르게 할 수 있다.[13-18] 최근에 개발되어 사용되는 실리콘 하이드로겔 렌즈는 산소투과성이 높으며 착용감이 우수하고 편리하지만 표면의 마모로 인해 각막 침윤증이 증가할 수 있으며, 이는 콘택트렌즈 표면에 형성된 바이오필름에 의해 심화될 수 있다.[7-10]
바이오필름이란 세균이나 진균이 단단한 고체표면물에 3차원적 구조의 군집락을 형성하는 것으로, 세균을 외부로부터 보호하는 효과를 가지고 있어 미생물의 생존을 증가시키며 항생제 침투를 어렵게 하여 치료에도 저항성을 나타내게 한다. 눈에 감염 될 수 있는 흔한 세균은 황색포도알균(Staphylococcus aureus), 폐렴균(Streptococcus pneumoniae), 녹농균(Pseudomonas aeruginosa), 인플루엔자균(Haemophilus influenzae)과 클렙시엘라 종(Klebsiella spp.) 등이 있으며,[19] 이 중 황색포도알균과 녹농균은 바이오필름을 형성하는 대표적인 균이다. 일부 전염성 안질환은 세균의 바이오필름 형성에서 기인하며, 콘택트렌즈의 장기적인 사용과 소홀한 관리로 인해 형성된 바이오필름은 콘택트렌즈 관련 미생물 감염을 심화시키는 위험 인자가 될 수 있다.[11,12] 또한 바이오필름은 많은 항생제에 대해 내성이 강하므로[20,21] 콘택트렌즈 사용에 있어서 바이오필름 형성을 예방하는 것이 매우 중요하다.
콘택트렌즈 사용의 증가와 동시에 관련 미생물 질환의 위험도 증가하는 추세이지만,[6,18] 콘택트렌즈 재질의 종류와 안질환 유발 미생물과의 상관성에 대한 연구는 미미한 실정이다. 선행된 연구들에서 콘택트렌즈 표면의 미세한 구조 차이 또는 중합체의 종류, 함수율, 이온성, 착색제에 따라 균의 부착성의 차이가 있다는 결과들을 보았을 때,[22-24] 콘택트렌즈의 재질에 따라 세균 증식의 정도와 바이오필름 형성 정도가 다를 것이라고 예상된다. 본 연구에서는 콘택트렌즈의 재질 차이에 의한 황색포도알균의 바이오필름 형성 정도와 관련 유전자 발현의 차이를 알아보고자 하였다.
대상 및 방법
1. 실험 렌즈
소프트 콘택트렌즈는 HEMA를 기반으로 하며 중합체 구성과 이온성에 차이를 보이는 FDA 분류기준 고함수, 비이온성인 2그룹에 속하는 hilafilcon B 재질과 고함수, 이온성인 4그룹에 속하는 etafilcon A 재질을 사용하였다(Table 1).
2. 균 배양 및 바이오필름 형성 유도
실험에 사용한 황색포도알균(KCTC 3881)은 생물자원센터(Korean Collection for Type Cultures)로부터 분양받았다. 황색포도알균은 실험에 사용하기 18-24시간 전에 nutrient broth 배지를 사용하여 37oC에서 배양하였다. 균을 렌즈에 접종하기 위해 균 배양액을 원심분리하여 PBS(phosphate buffered saline, NaCl 135 mM, KCl 2.7 mM, Na2HPO4 10 mM, KH2PO4 1.76 mM, pH 7.4)로 세 번 세척하고 분광광도계를 사용하여 595 nm에서 흡광도(optical density, O.D.)를 측정하여 균액의 농도를 일정하게 맞추었다. 24-well plate(Costar, Cambridge, MA, USA)에 일정한 농도의 균 배양액을 500 μl 씩 접종하고 렌즈의 볼록한 부분을 plate 바닥에 닿도록 하여 렌즈가 균 배양액에 완전히 잠기도록 하였다. 진탕 배양기에서 37oC, 75 rpm으로 90분간 배양하여 균을 부착시킨 후 PBS로 3회 세척하고 나서 tryptic soy broth(TSB)에서 48시간 동안 진탕 배양하여 바이오필름 형성을 유도하였다.
3. XTT assay
황색포도알균 배양액을 595 nm에서 0.02, 0.01, 0.005, 0.0025 O.D.로 농도를 맞춘 후 렌즈에 접종하여 48시간 동안 진탕 배양하여 바이오필름의 형성을 유도하였다. 배양 후 PBS로 3회 세척하여 미부착균을 제거하고 나서 각 well 마다 XTT(sodium 3′-[1-[(phenylamino)-carbony]-3,4-tetrazolium]-bis(4-methoxy-6-nitro)benzene-sulfonic acid hydrate)(1 mg/ml, Sigma, USA)와 menadione (0.4 mM, Sigma, USA)의 5:1 혼합액을 1 ml 씩 처리하여 빛을 차단한 상태로 37oC에서 1시간 반응시키고 microplate reader(Emax, Molecular Devices, Sunnyvale, CA, USA)를 사용하여 490 nm에서 흡광도를 측정하였다.
4. 건조중량
바이오필름이 형성된 렌즈를 PBS로 세척 후 37oC에서 24시간 동안 건조한 후 미세저울로 무게를 측정하였다. 아무 처리를 하지 않은 렌즈를 대조군으로 하여 렌즈에 형성된 바이오필름 생성물의 무게를 계산하였다.
5. 바이오필름 형성 관련 유전자 발현
바이오필름이 형성된 렌즈를 PBS로 3회 세척 후 500 μl의 TRI reagent®(Molecular Research Center, Inc., OH, USA)을 처리하여 10초간 교반하였다. 100 μl의 chloroform을 넣어 15초간 강하게 교반하고 15분간 실온에 방치한 후 4oC, 12,000 rpm에서 15분간 원심분리하여 상층액을 분리하였다. 상층액과 동량의 isopropanol을 넣어 가볍게 교반하여 실온에 15분간 방치한 후 10분간 4oC, 12,000 rpm에서 원심분리하여 mRNA를 분리하였다. 1 μg의 RNA로부터 MaximeTM RT PreMix Kit(iNtRON Biotechnology, MA, USA)를 사용하여 cDNA를 합성하였다.
바이오필름 형성관련 유전자들인 icaA, icaB, icaC, icaD, fnbA, fnbB 및 clfB 를 증폭할 수 있는 primer를 이용하여 PCR을 시행하였다(Table 2). cDNA 0.2 μg, forward primer 3 pmol, reverse primer 3 pmol, PCR 5X master mix (Elpis Biotech, Korea)를 혼합하여 총 20 μl의 반응용액으로 만들어 PCR을 수행하였다. PCR 결과물을 2% (w/v)의 agarose gel에서 전기영동하여 유전자 발현을 확인하였다.
cDNA 0.3 μg, forward primer 2 pmol, reverse primer 2 pmol, SYBR Green PCR premix (Life technologies, UK) 5 μl를 혼합하여 총 10 μl의 반응용액으로 만들어 ABI 7900HT(Applied Biosystems, Foster City, CA, USA)를 이용하여 50oC 2분, 95oC 10분 이후 95oC에서 15초, 60oC에서 45초의 반응을 40회 반복하였다. 각 유전자의 발현은 16S rRNA 의 발현과 비교하여 정량화하였다. 중합효소연쇄반응 결과는 실시간 중합효소연쇄반응 기기에 의해 실시간으로 측정되어 cycle threshold(Ct) 값으로 나타내었다.
6. 주사전자현미경
주사전자현미경적 관찰을 위하여 바이오필름이 형성된 렌즈를 PBS로 두 번 세척하고 2.5% glutaraldehyde에 고정시켰다. 1% osmium tetroxide를 1시간 동안 처리하여 고정된 렌즈는 70% 에탄올에 10분, 95% 에탄올에 10분, 100% 에탄올에 20분간 처리하여 탈수하였다. 탈수된 렌즈는 금도금 과정을 거쳐 주사전자현미경(TM-1000 15 kV, Hitachi, Japan)으로 관찰하였다.
7. 통계분석
각 항목에 대한 모든 측정치는 평균(mean) ± 표준편차(standard deviation)로 나타내었다. 렌즈간의 재질에 따른 결과적 차이는 T-test를 실시하였으며 유의성 검증은 신뢰구간 95%수준에서 시행하여 p<0.05 일 때 통계적으로 유의하다고 판정하였다.
결과 및 고찰
1. 렌즈 재질에 따른 바이오필름 형성의 비교
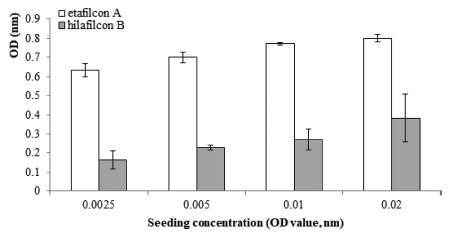
황색포도알균의 접종농도를 O.D.값 0.0025, 0.005, 0.01, 0.02로 맞추어 48시간 동안 배양하여 바이오필름의 형성을 유도한 결과, etafilcon A 재질의 렌즈에서 측정된 O.D. 값은 0.633±0.04, 0.700±0.03, 0.773±0.01, 0.802±0.02 으로 초기 접종농도에 비례하여 증가하였다. Hilafilcon B 재질의 렌즈에서 측정된 O.D.값은 0.161±0.05, 0.227±0.01, 0.270±0.05, 0.383±0.13으로 역시 접종농도에 비례하여 증가하였다(Fig. 1). 같은 접종농도에서 비교하였을 때, etafilcon A의 O.D.값은 hilafilcon B에 비해서 2-3배 정도 높게 나타났다(p<0.05).
황색포도알균의 접종농도를 O.D.값 0.1로 하여 48시간 동안 바이오필름을 형성을 유도한 후 건조중량을 측정한 결과(Fig. 2), etafilcon A 재질의 렌즈는 1.35±0.21 g, hilafilcon B 재질의 렌즈는 0.7±0.00 g으로 etafilcon A 재질의 렌즈에서 건조중량이 유의하게 증가되었다(p<0.05).
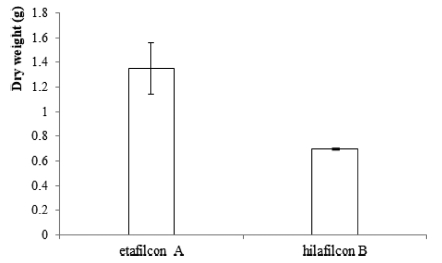
Measurement of biofilm formation of S. aureus by dry weight. The dry weight of S. aureus in contact lenses is significantly higher on etafilcon A than on hilafilcon B (*p<0.05).
바이오필름의 형성을 보기위한 XTT assay와 건조중량의 측정 결과를 보면 etafilcon A 재질의 콘택트렌즈에서 hilafilcon B 재질의 콘택트렌즈에 비해 황색포도알균의 바이오필름 형성이 많이 된다는 것을 볼 수 있었다. 이 결과는 기존의 연구[25]에서 etafilcon A, hilafilcon B, nelfilcon A를 사용하여 황색포도알균을 흡착시킨 후 고체배지에 배양하여 집락 수를 비교한 실험에서 etafilcon A, hilafilcon B, nelfilcon A 재질 순서로 황색포도알균이 많이 부착되었다는 결과와 같은 경향을 보였다. 본 연구에서는 기존의 연구와 다르게 렌즈에 균을 흡착시킨 후 48시간 동안 진탕 배양하고 PBS로 세척하는 과정을 거침으로써 단순히 균의 부착이 아닌 바이오필름의 형성을 유도하였다. 또한 XTT assay와 건조중량 측정으로 바이오필름의 형성 정도를 비교하였다. 그 결과 황색포도알균의 부착능 뿐 아니라 바이오필름 형성 정도도 콘택트렌즈 재질에 따라 다르게 나타난다는 점을 확인하였다.
2. 렌즈 재질에 따른 바이오필름 형성 관련 유전자의 발현 비교
XTT assay와 건조중량 측정을 통해 렌즈 재질에 따라 바이오필름 형성 정도가 다르다는 점을 확인하였으므로 바이오필름 형성과 관련된 유전자의 발현도 다른지 확인해보았다.
ica 유전자는 다당류 세포 간 부착 분자(polysaccharide intercellular adhesin; PIA)의 생합성을 유도하고 바이오필름 형성의 축적 단계에 관여하는 것으로 알려진 유전자이다. 이 중에서 icaA와icaD의 상호 작용은 황색포도알균에서 슬라임 층 형성과 바이오필름 형성에 중요하다고 여겨진다.[26] 본 연구에서는 바이오필름 형성 단계에 전반적으로 밀접한 관련이 있는 icaA, icaB, icaC, icaD 유전자의 발현을 역전사 PCR과 실시간 PCR을 통해 조사하였다. 역전사 PCR 결과(Fig. 3)를 보면 ica 유전자 모두 etafilcon A 재질의 렌즈에서 hilafilcon B 재질의 렌즈에 비해 1.5배 이상 높게 발현되었으며, icaB, icaC, icaD 발현은 통계적으로 유의하게 높았다(p<0.05). 유전자 발현을 정량적으로 분석하기 위해서 실시간 PCR을 시행하여 2^Ct값을 측정하였을 때 icaA는 etafilcon A에서 0.0554±0.022, hilafilcon B에서 0.0155±0.007, icaB는 etafilcon A에서 0.7860±0.060, hilafilcon B에서 0.3383±0.075, icaC는 etafilcon A에서 0.0087±0.002, hilafilcon B에서 0.0023±0.000, icaD는 etafilcon A에서 0.0168±0.003, hilafilcon B에서 0.0056±0.004로 측정되었다(Table 3). 이처럼 icaA, icaB, icaC, icaD 유전자의 발현은 etafilcon A에서 hilafilcon B에 비해 높게 나타났으며, icaA, icaB, icaC, icaD 유전자는 모두 통계적으로 유의한 차이를 보였다(p<0.01).

The gel electrophoresis of reverse transcription PCR products of the biofilm related intercellular adhesion genes(A). The expression level of the genes by reverse transcription PCR was adjusted to 16S rRNA value(B). In all genes, on etafilcon A showed higher expression level than on hilafilcon B, and icaB, icaC and icaD genes were statistically significant (*p<0.05). (E: etafilcon A, H: hilafilcon B).
Fibronectin binding protein은 숙주에 결합을 촉진함으로써 황색포도알균의 감염의 발병기전에 중심적인 역할을 한다.[27] clfB는 피브리노겐의 α 사슬에 결합하여 바이오필름 형성을 자극한다.[30] 본 연구에서는 바이오필름 형성 초기에 관련이 있는 fnbA, fnbB, clfB 유전자의 발현을 역전사 PCR과 실시간 PCR을 통해 조사하였다. 역전사 PCR에서 etafilcon A 재질의 렌즈가 hilafilcon B 재질의 렌즈보다 fnbA, fnbB, clfB 유전자의 발현이 모두 높게 나타났으며(Fig. 4), fnbB 유전자는 통계적으로 유의하게 차이를 보였다(p<0.05). 정량적인 유전자 발현을 알아보기 위하여 시행한 실시간 PCR에서는 fnbA는 etafilcon A에서 0.7443±0.318, hilafilcon B에서 0.1957±0.124, fnbB는 etafilcon A에서 0.0781±0.055, hilafilcon B에서 0.0223±0.005, clfB는 etafilcon A에서 1.9551±0.909, hilafilcon B에서 1.1597±0.797로 측정되었다(Table 3). 이처럼 fnb 그룹 유전자와 clfB 유전자의 경우 모든 유전자의 발현이 etafilcon A 재질에서 hilafilcon B 재질보다 높게 나타났으며, 이 중에서 fnbA, fnbB 유전자는 통계적으로 유의한 결과를 보였다(p<0.05).

The gel electrophoresis of reverse transcription PCR products of the biofilm related fibronectin binding protein genes and clumping factor gene(A). The expression level of the genes by reverse transcription PCR was adjusted to 16S rRNA value(B). In all genes, on etafilcon A showed higher expression level than on hilafilcon B, and fnbB gene were statistically significant (*p<0.05). (E: etafilcon A, H: hilafilcon B)
바이오필름 형성 과정에서 유전자 발현이 어떻게 달라지는지에 대한 연구는 많지 않으나 임상적으로 분리된 4종의 메티실린 내성 황색포도알균(methicillin resistant Staphylococcus aureus)을 사용하여 배양접시 상에서 바이오필름을 형성하여 실시간 PCR을 수행한 연구에서 균을 24시간 배양하여 바이오필름이 형성된 경우에 icaA, icaB, icaC, icaD, fnbA, fnbB의 발현이 크게 증가하였다는 보고[28]가 있었다. 본 연구에서도 황색포도알균을 부유상태로 두었을 때보다 바이오필름 형성을 유도하였을 때 icaA, icaB, icaC, icaD, fnbA, fnbB 발현이 증가된 것을 관찰하였으며, 렌즈 재질에 따라서도 차이가 난다는 것을 확인하였다.
3. 주사전자현미경을 통한 렌즈 표면의 바이오필름 형성 차이
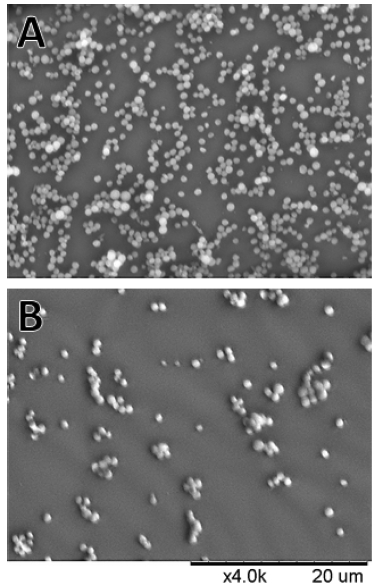
황색포도알균을 콘택트렌즈에 48시간 동안 진탕 배양하여 바이오필름의 형성을 유도한 후 etafilcon A 재질과 hilafilcon B 재질의 콘택트렌즈 표면에 형성한 바이오필름을 주사전자현미경 하에서 4,000배 확대하여 관찰하였다. Etafilcon A 재질의 렌즈 표면에서는 전체적으로 황색포도알균이 부착되어 있는 밀도가 높았으며, 황색포도알균 세포끼리도 여러 층을 형성하며 붙어있는 모양이었다. Hilafilcon B 재질의 콘택트렌즈는 etafilcon A 재질과 비교하여 표면에 부착되어 있는 황색포도알균의 수가 현저히 적었으며 균의 세포끼리도 많이 뭉쳐있지 않은 모습이었다(Fig. 6).
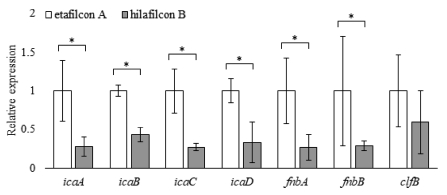
Comparison of the mRNA levels of biofilm related genes on etafilcon A and on hilafilcon B. Relative expression of the biofilm related genes were determined by realtime-PCR. The expression levels of icaA, icaB, icaC, icaD, fnbA and fnbB gene were significantly higher on etafilcon A than on hilafilcon B (*p<0.05).
본 연구에서 XTT assay, 건조중량 측정, 역전사 PCR과 실시간 PCR을 이용한 바이오필름 형성 관련 유전자 발현측정, 주사전자현미경 관찰을 통해 살펴본 결과 황색포도알균의 바이오필름 형성은 etafilcon A 재질에서 hilafilcon B 재질보다 활발하다는 것을 확인할 수 있었다. 이렇게 렌즈 재질에 따라 균의 바이오필름 형성에 차이가 나는 요인을 살펴보면, 먼저 etafilcon A 재질은 이온성이고 hilafilcon B 재질은 비이온성이므로 렌즈의 이온성이 영향을 미칠 가능성을 생각할 수 있다. 또한 콘택트렌즈에 부착하는 단백질로는 강한 양전하를 띄는 라이소자임의 침착이 가장 많으며, 반대로 음전하를 띄는 알부민의 침착은 적다는 보고[25,29]에서 알 수 있듯이 렌즈의 이온성은 물질의 부착에 영향을 주고 균의 부착에 영향을 미칠 수 있다. 또한 etafilcon A 재질은 HEMA와 MA의 중합체이고, hilafilcon B 재질은 HEMA와 NVP의 중합체로 구성되어 있어서 이러한 재질의 차이가 영향을 줄 수 있다. HEMA로만 되어있는 재질보다 HEMA와 MA가 함께 제조된 렌즈에서 황색포도알균의 흡착이 더 많았다고 연구[31]되어 중합체의 차이가 균 흡착에 영향을 주는 주요 요인인 것으로 보고된 바가 있다. 그 외에도 콘택트렌즈의 재질이 균의 흡착에 영향을 준다는 기존의 연구들이 있었다. 유사한 표면 특성을 갖는 같은 FDA 그룹 렌즈 사이에서도 중합된 모노머의 종류에 따라 균의 흡착량이 달라질 수 있다[32]는 연구가 있었으며, etafilcon A 렌즈에서 hilafilcon B 렌즈보다 황색포도알균의 흡착이 많다는 보고[25]도 있었다. 본 연구에서는 렌즈의 재질에 따른 균의 흡착 뿐만 아니라 바이오필름의 형성도 렌즈 재질에 따라 차이가 나는지 알아본 바, etafilcon A 재질에서는 hilafilcon B 재질에 비해 바이오필름 형성이 높았으며, 관련 유전자의 발현 또한 증가된다는 것을 확인하였다. 그러나 균의 바이오필름의 형성에는 시간이 걸리므로 렌즈 착용시간이 짧거나 적절하게 관리되는 경우는 큰 영향을 주지않을 가능성이 있으며, 바이오필름 형성의 차이가 임상적으로 어떤 영향을 미치는지는 추가적인 연구가 필요하다. 본 연구 결과는 기존에 염증이나 안질환 등 선행요인이 있는 사용자에서 콘택트렌즈 선택에 활용될 수 있을 것으로 생각된다.
결 론
본 연구에서는 소프트 하이드로겔 콘택트렌즈의 재질에 따른 황색포도알균의 바이오필름 형성 및 관련 유전자 발현의 차이를 알아보았다. XTT assay와 건조중량 측정을 통한 바이오필름 형성 정도의 차이를 비교하였을 때, XTT assay에서는 접종농도에 비례하여 etafilcon A 재질의 렌즈에서 hilafilcon B 재질의 렌즈보다 통계적으로 유의하게 바이오필름 형성이 많았으며, 건조중량 측정에서도 etafilcon A가 통계적으로 더 유의하게 높은 결과를 보였다. 바이오필름 형성에 관련된 유전자의 발현을 비교한 결과에서는 역전사 PCR과 실시간 PCR 모두 etafilcon A 재질의 렌즈에서 hilafilcon B 재질의 렌즈보다 바이오필름 형성 관련 유전자의 발현이 높게 나타났으며, 실시간 PCR에서 icaA, icaB, icaC, icaD, fnbA, fnbB 유전자의 발현차이가 유의하게 나타났다. 주사전자현미경을 통한 렌즈 표면의 바이오필름 형성 관찰에서도 etafilcon A 재질의 렌즈에 hilafilcon B 재질의 렌즈보다 더 많은 수와 여러 층의 균이 부착되어 있는 것을 관찰할 수 있었다. 이로서 본 연구에서는 동일한 조건 하에서 etafilcon A 재질의 렌즈에서 hilafilcon B 재질의 렌즈보다 바이오필름 형성이 더 많이 된다는 것을 알 수 있었다.
Acknowledgments
본 논문의 일부내용은 2017년도 KMB 국제학술대회 및 정기학술대회 포스터로 발표 되었음.
본 연구의 재료비의 일부는 강원도 교육청에서 지원되었습니다.
References
- Kim, DH, Sung, AY, An introduction of contact lens, 1st Ed, Hyunmoon, (2004), p28-134.
- Kumar, MNV, A review of chitin and chitosan applications, React Funct Polym, (2000), 46(1), p1-27.
- Cope, JR, Collier, SA, Nethercut, H, Jones, JM, Yates, K, Yoder, JS, Risk behaviors for contact lens–related eye infections among adults and adolescents, MMWR Morb Mortal Wkly Rep, (2017), 66(32), p841-845.
-
Kim, KS, Kim, SK, Kim, TH, Kim, HJ, Comparison of corneal edema induced by material of contact lens, J Korean Ophthalmic Opt Soc, (2015), 20(2), p151-156.
[https://doi.org/10.14479/jkoos.2015.20.2.151]

-
Stapleton, F, Carnt, N, Contact lens-related microbial keratitis: how have epidemiology and genetics helped us with pathogenesis and prophylaxis, Eye(Lond), (2012), 26(2), p185-193.
[https://doi.org/10.1038/eye.2011.288]

- Dyavaiah, M, Phaniendra, A, Sudharshan, SJ, Microbial keratitis in contact lens wearers, JSM Ophthalmol, (2015), 3(3), p1036-1048.
- Willcox, MD, Microbial adhesion to silicone hydrogel lenses: a review, Eye Contact Lens, (2013), 39(1), p61-66.
-
Borazjani, RN, Levy, B, Ahearn, DG, Relative primary adhesion of Pseudomonas aeruginosa, Serratia marcescens and Staphylococcus aureus to HEMA-type contact lenses and an extended wear silicone hydrogel contact lens of high oxygen permeability, Cont Lens Anterior Eye, (2004), 27(1), p3-8.
[https://doi.org/10.1016/j.clae.2003.08.001]

-
Kodjikian, L, Casoli-Bergeron, E, Malet, F, Janin-Manificat, H, Freney, J, Burillon, C, et al. , Bacterial adhesion to conventional hydrogel and new silicone-hydrogel contact lens materials, Graefes Arch Clin Exp Ophthalmol, (2008), 246(2), p267-273.
[https://doi.org/10.1007/s00417-007-0703-5]

-
Vijay, AK, Zhu, H, Ozkan, J, Wu, D, Masoudi, S, Bandara, R, et al. , Bacterial adhesion to unworn and worn silicone hydrogel lenses, Optom Vis Sci, (2012), 89(8), p1095-1106.
[https://doi.org/10.1097/opx.0b013e318264f4dc]

- Götz, F, Staphylococcus and biofilms, Mol Microbiol, (2002), 43(6), p1367-1378.
-
Boles, BR, Horswill, AR, Staphylococcal biofilm disassembly, Trends Microbiol, (2011), 19(9), p449-455.
[https://doi.org/10.1016/j.tim.2011.06.004]

- Wu, P, Stapleton, F, Willcox, MD, The causes of and cures for contact lens-induced peripheral ulcer, Eye Contact Lens, (2003), 29(1), pS63-S66.
-
Edwards, K, Keay, L, Naduvilath, T, Snibson, G, Taylor, H, Stapleton, F, Characteristics of and risk factors for contact lens-related microbial keratitis in a tertiary referral hospital, Eye(Lond), (2009), 23(1), p153-160.
[https://doi.org/10.1038/sj.eye.6702953]

-
Bourcier, T, Thomas, F, Borderie, V, Chaumeil, C, Laroche, L, Bacterial keratitis: predisposing factors, clinical and microbiological review of 300 cases, Br J Ophthalmol, (2003), 87(7), p834-838.
[https://doi.org/10.1136/bjo.87.7.834]

- Keay, L, Edwards, K, Naduvilath, T, Taylor, HR, Snibson, GR, Forde, K, et al. , Microbial keratitis predisposing factors and morbidity, Ophthalmology, (2006), 113(1), p109-116.
-
Mela, EK, Giannelou, IP, Koliopoulos, JX, Gartaganis, SP, Ulcerative keratitis in contact lens wearers, Eye Contact Lens, (2003), 29(4), p207-209.
[https://doi.org/10.1097/01.icl.0000078102.30635.a7]

-
Kim, JH, Song, JS, Hyon, JY, Chung, SK, Kim, TJ, A survey of contact lens-related complications in Korea: the Korean contact lens study society, J Korean Ophthalmol Soc, (2014), 55(1), p20-31.
[https://doi.org/10.3341/jkos.2014.55.1.20]

-
Bharathi, MJ, Ramakrishnan, R, Shivakumar, C, Meenakshi, R, Lionalraj, D, Etiology and antibacterial susceptibility pattern of community-acquired bacterial ocular infections in a tertiary eye care hospital in south India, Indian J Ophthalmol, (2010), 58(6), p497-507.
[https://doi.org/10.4103/0301-4738.71678]

-
Fulcher, TP, Dart, JK, McLaughlin-Borlace, L, Howes, R, Matheson, M, Cree, I, Demonstration of biofilm in infectious crystalline keratopathy using ruthenium red and electron microscopy, Ophthalmology, (2001), 108(6), p1088-1092.
[https://doi.org/10.1016/s0161-6420(01)00561-9]

-
Rossetti, S, D'Alessandro, L, Pellegrino, F, Carrasco, MA, The effect of ketorolac on biofilm of Staphylococcus epidermidis isolated from post-cataract endophthalmitis, J Ophthalmic Inflamm Infect, (2012), 2(2), p89-93.
[https://doi.org/10.1007/s12348-012-0070-1]

-
Henriques, M, Sousa, C, Lira, M, Elisabete, M, Oliveira, R, Oliveira, R, Azeredo, J, Adhesion of Pseudomonas aeruginosa and Staphylococcus epidermidis to silicone-hydrogel contact lenses, Optom Vis Sci, (2005), 82(6), p446-450.
[https://doi.org/10.1097/01.opx.0000168585.53845.64]

-
Sung, HK, Kim, SR, Park, M, Comparisons of adherence level of micro-organisms according to contact lens materials and protein deposition and disinfection efficacy of multipurpose solution, J Korean Ophthalmic Opt Soc, (2015), 20(1), p35-42.
[https://doi.org/10.14479/jkoos.2015.20.1.35]

-
Ji, YW, Hong, SH, Chung, DY, Kim, EK, Lee, HK, Comparison of surface roughness and bacterial adhesion between cosmetic contact lenses and conventional contact lenses, J Korean Ophthalmol Soc, (2014), 55(5), p646-655.
[https://doi.org/10.3341/jkos.2014.55.5.646]

-
Park, SH, Park, IS, Kim, SR, Park, M, Relationship between the deposition of tear constituents on soft contact lenses according to material and pigmentation and adherence of Staphylococcus aureus, J Korean Ophthalmic Opt Soc, (2016), 21(2), p109-117.
[https://doi.org/10.14479/jkoos.2016.21.2.109]

- Namvar, AE, Asghari, B, Ezzatifar, F, Azizi, G, Lari, AR, Detection of the intercellular adhesion gene cluster (ica) in clinical Staphylococcus aureus isolates, GMS Hyg Infect Control, (2013), 8(1), pDoc03.
-
Lower, SK, Lamlertthon, S, Casillas-Ituarte, NN, Lins, RD, Yongsunthon, R, Taylor, ES, et al. , Polymorphisms in fibronectin binding protein A of Staphylococcus aureus are associated with infection of cardiovascular devices, Proc Natl Acad Sci USA, (2011), 108(45), p18372-18377.
[https://doi.org/10.1073/pnas.1109071108]

-
Atshan, SS, Shamsudin, MN, Karunanidhi, A, van Belkum, A, Lung, LT, Sekawi, Z, et al. , Quantitative PCR analysis of genes expressed during biofilm development of methicillin resistant Staphylococcus aureus (MRSA), Infect Genet Evol, (2013), 18, p106-112.
[https://doi.org/10.1016/j.meegid.2013.05.002]

-
Suwala, M, Glasier, MA, Subbaraman, LN, Jones, L, Quantity and conformation of lysozyme deposited on conventional and silicone hydrogel contact lens materials using an in vitro model, Eye Contact Lens, (2007), 33(3), p138-143.
[https://doi.org/10.1097/01.icl.0000244155.87409.f6]

- Deodurg, SM, Katti, AS, Sulochana, MB, In silico analysis of clumping factors clfA and clfB of multidrug-resistant Staphylococcus aureus MRSA 252 strain, Int J Adv Biotechnol Res, (2016), 7(3), p1103-1110.
-
Fleiszig, SM, Evans, DJ, Mowrey-McKee, MF, Payor, R, Zaidi, TS, Vallas, V, et al. , Factors affecting Staphylococcus epidermidis adhesion to contact lenses, Optom Vis Sci, (1996), 73(9), p590-594.
[https://doi.org/10.1097/00006324-199609000-00005]

- Onurdağ, FK, Ozkan, S, Ozgen, S, Olmuş, H, Abbasoğlu, U, Candida albicans and Pseudomonas aeruginosa adhesion on soft contact lenses, Graefes Arch Clin Exp Ophthalmol, (2011), 249(4), p559-564.