고분자 코팅이 폴리페놀을 함유한 콘택트렌즈의 항산화 활성 및 특성에 미치는 효과
초록
폴리페놀을 함유한 실리콘 하이드로겔 콘택트렌즈를 제작하고, 알지네이트와 폴리아크릴산을 사용한 layer by layer(LBL) 코팅을 통한 콘택트렌즈의 다양한 물리적 특성과 항산화 활성을 살펴보고자 한다.
항산화제인 카페인산과 클로로겐산이 포함된 콘택트렌즈를 제작하여 고분자인 알지네이트와 폴리아크릴산으로 LBL 표면코팅을 하였다. 함수율, 산소투과율, 광투과율, 두께 등 물리적 특성과 항산화 활성, 항균성, 표면분석 등을 진행하였다.
카페인산과 클로로겐산이 포함된 콘택트렌즈의 항산화성을 확인하였으며, LBL 코팅을 함으로써 함수율과 두께가 증가하였다. LBL층이 증가할수록 항산화제 방출 지속시간이 향상되었다.
카페인산과 클로로겐산이 포함된 콘택트렌즈의 고분자 코팅을 통해 항산화성과 항균성을 확인히고 항산화제의 방출 지속 시간이 향상됨을 알았다.
Abstract
To fabricate silicone hydrogel contact lenses containing polyphenols and to investigate the various physical properties and antioxidant activity of the contact lenses through ayer by ayer (LBL) coating using alginate and polyacrylic acid (PAA).
Contact lenses containing antioxidants, caffeic acid and chlorogenic acid, were fabricated and surface-coated with LBL using polymers, alginate and PAA. hysical properties, water content, oxygen transmissibility, light transmittance, and thickness, as well as antioxidant activity, antibacterial activity, and surface.
The antioxidant activity of contact lenses containing caffeic acid and chlorogenic acid was confirmed, and the water contents and thickness increased by LBL coating. As the LBL layer increased, the antioxidant release duration improved.
The antioxidant and antibacterial activities were confirmed and the antioxidant release duration was improved through polymer coating of contact lenses containing caffeic acid and chlorogenic acid.
Keywords:
Contact lenses, Caffeic acid, Chlorogenic acid, LBL coating, Antioxidant activity키워드:
콘택트렌즈, 카페인산, 클로로겐산, LBL 코팅, 항산화성서 론
하이드로겔은 생분해성, 생체적합성, 무독성, 안정성이 뛰어나 상처 드레싱이나 생물 장벽 재료로 사용되는 등 생물 의학 응용 분야와 조직 공학 및 재생 분야에서 활발히 활용되고 있다.[1,2] 하이드로겔 콘택트렌즈는 시력 교정용으로 오랜 기간 사용되어 왔으며, 최근에는 약물 전달, 항산화 및 항균 기능 등 다양한 의료적 목적을 위해 그 활용 범위가 확장되고 있다.[3]
인체에 발생하는 안구 질환을 치료하기 위해 사용되는 약물은 90% 이상이 점안액이나 안연고의 형태이다.[4] 하지만 점안액의 경우 체류 시간이 2분 정도에 불과하고, 약물의 5% 정도만 사용되며 나머지 대부분의 약물은 결막에 흡수되거나 비강 내 배출을 통해 전신 순환계로 들어가게 된다.[5] 이를 해결하기 위해 약물 방출 제어를 위한 약물 전달체 연구가 활발히 진행되고 있으며, 약물 전달시스템으로서의 콘택트렌즈 연구도 주목받고 있다. 하이드로겔 콘택트렌즈는 물리적 및 화학적 결합 방식을 모두 적용할 수 있어 로딩된 약물과 하이드로겔 사이의 결합을 증가시키고 약물 방출 시간을 연장할 수 있다.[6] 이처럼 콘택트렌즈 기반 안과 약물 전달 시스템은 형태, 투명성, 안정성 및 산소 투과성과 같은 자체 특성에 영향을 주지 않으면서 많은 양의 약물을 로딩하고 방출량을 제어할 수 있다.[7]
하이드로겔 콘택트렌즈는 착용감이 우수하나, 장시간 사용 시 활성산소(reactive oxygen species; ROS)와 관련된 문제를 야기할 수 있다. 활성산소는 산소 분자의 부분적 환원으로 인해 발생하며 이로 인해 DNA, 단백질, 지질 등이 손상을 입어 세포 기능 장애, 염증 등을 유발한다. 산소전달률이 낮은 하이드로겔 소재는 각막저산소증을 유발할 수 있으며 백내장, 각막 및 망막 손상 등 각종 안과질환의 원인이 된다.[8]
실리콘 소재의 콘택트렌즈는 기존 하이드로겔 콘택트렌즈에 비해 높은 산소 투과율과 유연성을 제공하여 각막에 충분한 산소를 공급할 수 있다. 이를 통해 하이드로겔 콘택트렌즈의 각막 손상 및 질병의 위험을 줄일 수 있다.
안과질환을 유발하는 활성산소를 제거하기 위하여 사용되는 가장 효과적이고 편리한 수단은 항산화제를 사용하는 것이다. 항산화제는 다양한 메커니즘과 활성을 통해 활성산소에 대한 억제 효과를 발휘하며, 동물, 식물, 미생물 등 자연적으로 발생하거나 화학적 합성을 통해 생성될 수 있다. 합성 항산화제는 낮은 비용과 광범위한 활용성으로 인해 주로 사용되었으나 장기간 사용 시 잠재적 부작용이 유발될 수 있어 천연 항산화제에 대한 관심이 높아지고 있다.[9] 천연 항산화제는 향신료, 허브, 과일, 곡물뿐만 아니라 조류, 어패류와 같은 해양 자원에서도 발견되며[10], 그 예로 페놀산, 탄닌산, 로즈마린산, 티몰 등이 있다.[11] 그 중 카페인산(caffeic acid)과 클로로겐산(chlorogenic acid)은 항산화제로, 하이드록실기를 가지는 하이드록시신 남산으로서 커피의 대표 생체 활성 화합물이다.[12,13] 이 두 가지 커피 추출 항산화 물질은 강력한 항산화 효과 뿐만 아니라 항염증 작용을 비롯하여 항균, 항암 등 다양한 효능을 가지고 있어 질병 치료 및 예방에 사용될 수 있다.[14-17]
하이드로겔을 이용한 약물 전달체는 Layer by layer(LBL) 코팅을 많이 사용하며, LBL은 최소 2가지의 상호 보완적인 작용을 나타내는 용액을 순차적으로 노출시켜 나노미터 다층구조를 형성하며, 폴리전해질, 양극성 친수성 물질, 반대전하를 띄는 입자 등 다양한 방식으로 다층 필름을 조립한다. 금속부터 세포까지 다양한 표면 유형을 코팅하는 간단하고 다용도 활용이 가능한 기술이며 생물의학, 나노 아키텍처 엔지니어링, 약물 전달 등 다양한 응용 분야에서 사용할 수 있다.[18]
콘택트렌즈를 이용한 약물전달에 대한 연구는 최근 들어 활발히 진행[19-21]되고 있으나 약물 방출 지속 시간 연장, 항산화성에 관한 연구는 상대적으로 부족하다.
본 연구는 카페인산과 클로로겐산과 같은 항산화제가 탑재된 실리콘 하이드로겔 콘택트렌즈를 제작하고, 알지네이트(alginate)와 폴리아크릴산(polyacrylic acid)을 LBL 코팅하여 물리적 특성을 평가하고, 콘택트렌즈의 항산화성과 항산화 효과의 지속시간을 살펴보고자 한다.
재료 및 방법
1. 실험
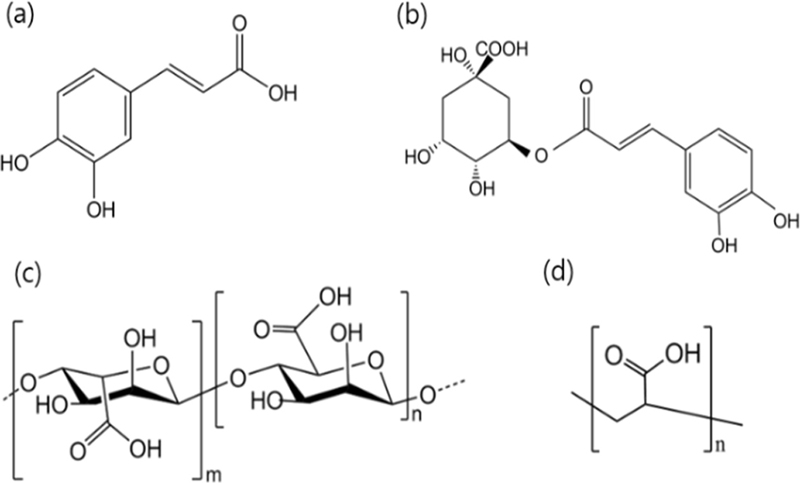
실리콘 하이드로겔 렌즈 제조를 위해 사용된 단량체는 실리콘 단량체인(3-methacryloxy-2-hydroxypropoxy)propylbis(trimethylsiloxy)methylsilane(SiGMA, GEO Specialty Chemicals, USA), 친수성 단량체인 N-vinyl-2-pyrrolidone(NVP), N,N-dimethylacrylamide(DMA)를 사용하였다. 가교제로 ethylene glycol dimethacrylate(EGDMA)를 사용하였고, 개시제로 2,2-Azobisisobutyronitrile(AIBN, Junsei chemical Co., Japan)을 사용하였다. 콘택트렌즈의 항산화성을 확인하기 위해 사용된 약물은 caffeic acid, chlorogenic acid였으며, layer by layer(LBL) 코팅을 위해 polyethyleneimine(PEI)와 polyacrylic acid(PAA), 천연다당류인 sodium alginate를 사용하였다. Fig. 1에 단량체 구조를 제시하였다. SiGMA와 AIBN을 제외한 모든 시약은 sigma-Aldrich(USA) 사에서 구입하여 사용하였다.
연구에 사용할 콘택트렌즈 제작을 위해 친수성 단량체인 NVP, DMA를 사용하였고, 가교제로 EGDMA, 개시제로서 AIBN을 사용하였다. 추가로 산소투과성을 높이기 위하여 실리콘 단량체인 SiGMA를 사용하였다. 카페인산과 클로로겐산 두 약물 모두 전체 농도 0.1%에 도달할 때까지 에탄올에 용해하였다. 구체적인 구성 물질과 혼합비율은 Table 1에 제시하였다.
모든 콘택트렌즈 시료는 polypropylene(P.P) 소재의 0.00D 몰드를 사용하였으며 15분 동안 교반 후 100oC 1시간 동안 열중합하였다. 중합된 콘택트렌즈는 몰드에서 분리하여 증류수에 3회 씻어내 미반응 단량체를 제거하였다.
약물의 지속적인 방출을 위한 LBL코팅을 진행하기 위해 다음과 같은 절차를 수행하였다. 먼저 약물이 포함된 콘택트렌즈를 양전하를 띄는 PEI 수용액(10 mg/mL)에 5분 동안 침지하였다. 그 후, 알지네이트 용액(1 mg/mL)에 10분 동안 침지하여 코팅층을 형성하고 마지막으로 폴리아크릴산(1 mg/mL)에 추가로 10분을 침지하여 두 번째 코팅층을 형성하였다. 이 순차적인 과정을 통해 콘택트렌즈의 지속적이고 안정적인 약물 방출을 위한 이중층 구조가 형성되었다.
시료의 명명은 약물을 포함하지 않는 기본 시료는 RE, LBL을 진행하지 않고 약물만 넣은 경우 약물의 종류에 따라 카페인산이 함유된 렌즈는 CA, 클로로겐산이 함유된 렌즈는 CH로 명명하였으며, LBL코팅에 사용된 시약의 종류에 따라 알지네이트로 코팅된 시료는 각각 CAA, CHA, 알지네이트/폴리아크릴산으로 이중 코팅된 시료는 CAAP, CHAP로 명명하였다.
제작한 콘택트렌즈의 함수율 측정은 ISO 18369-4:2017에 명시된 중량측정법(gravimetric method)에 따라 측정되었다. LBL코팅을 하지 않은 RE, CA, CH 콘택트렌즈는 실온에서 PBS에 24시간 수화하였으며 LBL코팅을 진행한 CAA, CHA, CAAP, CHAP 콘택트렌즈는 LBL코팅 완료 후 PBS에 3회 세척하여 24시간 수화하였다. 모든 시료는 각각 10회씩 측정하여 평균값으로 제시하였다.
광투과율 측정은 Agilent사의 Cary 60 UV-Vis spectrophotometer를 사용하였다. ISO 기준 가시광선(380 nm~780 nm) 영역에 대한 투광도를 측정하였으며, 각 시료의 평균값을 백분율로 나타내었다.
산소전달률 측정은 polarographic method를 사용하여 측정하였다. WL1000S(WITHLAB, Korea) 항온항습기 내부 온도 36oC±0.5oC, 습도 98%의 환경에서 2시간 이상 안정화한 시료를 사용하였으며, Model 201T permeomterTM(CREATECH, U.S)로 측정된 전류값을 통해 산소침투성과 산소전달률을 측정하였다. 콘택트렌즈의 두께는 Litematic VL-50(Mitutoyo, Japan)을 사용하여 측정하였으며 각 시료당 3회씩 측정 후, 그 평균값으로 제시하였다.
커피에 포함된 항산화제의 항산화성 측정을 위해 DPPH 용액(0.2 mM)을 사용하여 시간에 따른 라디칼소거 정도를 살펴 평가하였다. 이때 라디칼 소거율은 UV-Vis spectrophotometer(Agilent, Cary 60 UV-Vis)를 사용하여 517 nm에서 흡광도 변화를 측정하여 계산하였다. 이때 약물을 포함한 콘택트렌즈의 DPPH 용액 침지 시간은 30분이었다. 사용할 시료들은 각각 증류수에 2회 세척 후 에탄올에 희석한 DPPH 용액(0.2 mM) 3 ml에 첨가하여 빛이 차단된 상태로 측정하였다.
콘택트렌즈의 표면분석을 위해 주사전자현미경(scanning electron microscope; SEM)과 원자힘 현미경(atomic force microscopy; AFM)을 측정하였다. 주사전자현미경(SEM)은 20 mA, 60초 동안 3.25 nm의 두께로 gold coating한 후, TESCAN사의 MIRA3을 사용하여 측정하였다. 원자힘현미경(AFM)은 아이에스비사의 TFD8503 동결건조기(freeze dryer)를 사용하여 시료를 건조한 후 Parck systems사의 NX10을 사용하여 5×5 μm의 면적을 이미지화하여 표면분석 하였다.
카페인산과 클로로겐산을 포함한 콘택트렌즈와 알지네이트와 폴리아크릴산으로 LBL 코팅된 콘택트렌즈의 항균성을 확인하였다. 균주는 한국 미생물 보존 센터에서 분양받은 E-coli(ATCC 10536)를 사용하여 진행하였으며, 실험에 사용된 액체 배지는 증류수 200 mL에 pepton 1g, beef 0.6 g을 마그네틱 바로 교반하여 pH 7.2로 맞춰 멸균기를 사용해 멸균하였다. 10 mL의 액체 배지에 분양받은 E-coli을 1 μl 넣고 24시간 동안 37oC에서 1차 배양 후 사용하였다. 10 mL의 액체 배지가 담긴 바이알에 각 렌즈 시료를 넣고 배양시킨 E-coli을 3 μl 넣어 3시간 동안 37oCs에서 배양한 후 식염수를 사용하여 10,000배로 희석하였다. 희석된 용액을 건조 필름 배지(E-coli, 3M PetrifilmTM)에 1 mL씩 도말하고, 37oC에서 24시간 동안 인큐베이션하였다. CFU(colony forming unit)는 각 시료 당 3회씩 측정한 평균값으로 구하였다.
결과 및 고찰
1. 콘택트렌즈의 항산화성
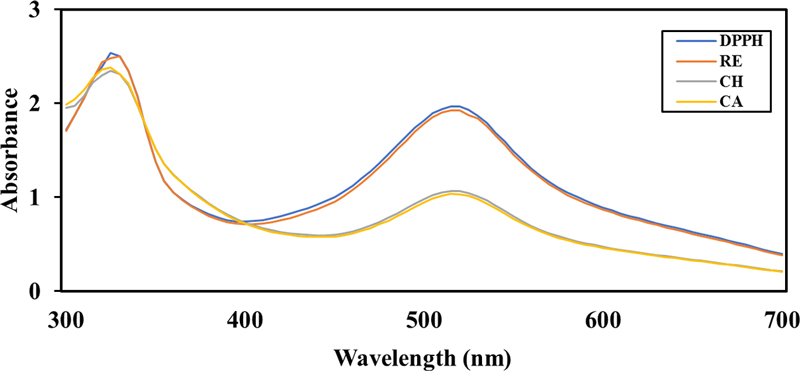
카페인산과 클로로겐산을 함유한 콘택트렌즈를 제작하고 항산화성을 확인하여 Fig. 2에 제시하였다. DPPH를 사용하여 라디칼 소거능을 확인한 흡광도 그래프를 보면 517 nm에서 DPPH 용액(0.2 mM)과 비교했을 때 약물이 포함되지 않은 콘택트렌즈 RE와 흡광도 차이가 거의 없다. 반면 폴리페놀을 포함한 CA, CH의 경우 각각 52.64%, 54.35%의 라디칼 소거율을 보였으며 DPPH 용액에 비해 흡광도가 많이 감소된 것을 볼 수 있었다. 이는 커피 속의 카페인산과 클로로겐산이 항산화 효과 있다는 기존 연구[22]와 일치한 결과임을 확인하였다.
제작된 콘택트렌즈에 해조다당류인 알지네이트와 폴리아크릴산으로 각각 LBL코팅을 진행하였을 때와 알지네이트와 폴리아크릴산을 단계별로 LBL코팅을 진행하였을 때의 약물 방출 지속 시간을 비교하기 위해 용출된 약물의 라디칼 소거율을 계산하여 Fig. 3에 나타내었다. 이때 LBL 코팅을 하지 않는 CA, CH 시료는 CAA, CHA, CAAP, CHAP의 LBL 코팅 진행 시간을 고려하여 증류수에 30분 수화 후 DPPH 용액에 첨가하였다.
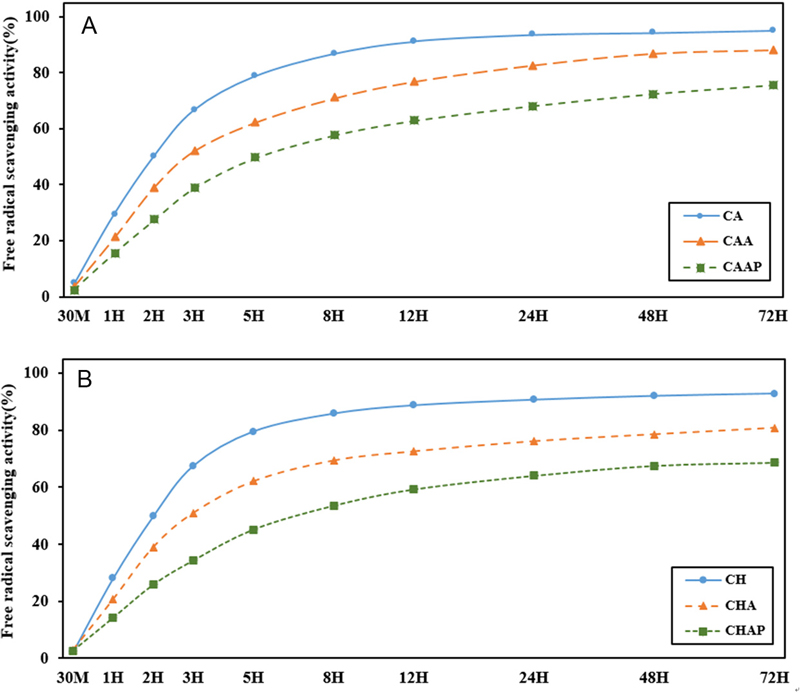
Relative radical scavenging capacities of LBL-coated contact lenses containing (a) caffeic acid and (b) chlorogenic acid.
카페인산을 포함하고 LBL 코팅을 하지 않은 CA 콘택트렌즈의 경우 72시간 동안 측정한 결과 94.82%의 라디칼 소거율을 보여주었으며, 알지네이트로 단층 코팅한 CAA는 88.62%, 그리고 알지네이트와 폴리아크릴산으로 이중 코팅한 CAAP의 경우는 75.49%의 라디칼 소거능을 보였다(Fig. 3(a)). 클로로겐산의 경우, CH는 92.78%, CHA는 76.78%, 그리고 이중 코팅한 CHAP는 68.60%의 라디칼소거능을 보여주었다(Fig. 3(b)).
LBL층을 형성하지 않은 CA, CH 콘택트렌즈의 자유라디칼 소거는 12시간까지 90% 이상이 나타났으나 그 이후에는 더 이상 진행되지 않았다. 그러나 LBL 코팅이 이루어진 콘택트렌즈들은 72시간 동안 꾸준히 라디칼 소거율이 진행되고 있었다. 알지네이트와 폴리아크릴산으로 이중 코팅한 렌즈는 자유라디칼소거율이 단층 코팅 렌즈보다 다소 낮게 나타났으나 지속성은 더 좋았다. 이러한 결과는 음이온성인 카페인산과 클로로겐산이 양이온성의 PEI와 결합하여, 음이온성 천연 다당류인 알지네이트와 친수성 고분자인 폴리아크릴산과 다시 이온 결합을 형성하기 때문이다. 이러한 이온결합을 통해 형성된 이중층 LBL코팅은 약물 방출량을 억제하고 방출 시간을 효과적으로 제어한다.[23,24] 따라서 카페인산, 클로로겐산 모두 LBL층 형성을 통해 콘택트렌즈 내부에 있는 약물의 용출속도를 조절할 수 있음을 확인하였다.
2. 항산화 콘택트렌즈의 물리적 특성 평가
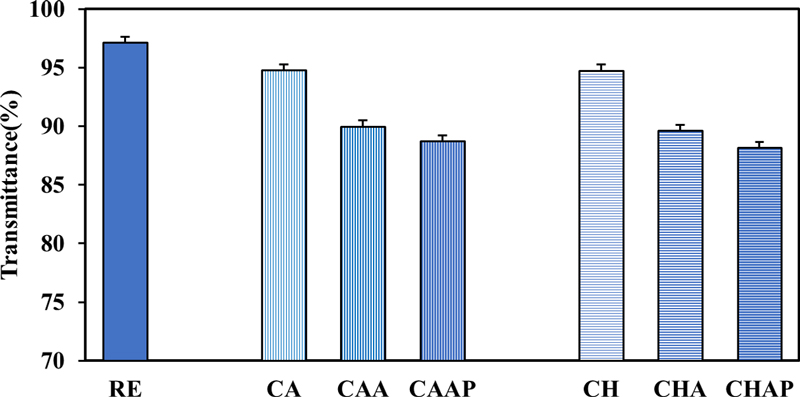
항산화제를 포함한 콘택트렌즈에 알지네이트와 폴리아크릴산으로 LBL 코팅한 콘택트렌즈의 광투과율을 Fig. 4에 나타내었다. 항산화제가 포함되지 않고 LBL층을 형성하지 않은 RE의 광투과율은 97.14%였다. CA와 CH는 각각 94.78%, 94.75%의 비슷한 광투과율을 보였으며, 단층 코팅한 CAA, CHA는 89.97%, 89.62%로 코팅하지 않은 렌즈에 비해 다소 감소하였다. 그리고 이중 코팅한 CAAP, CHAP는 각각 88.73%, 88.17%의 광투과율을 보였다. 따라서 알지네이트와 폴리아크릴산으로 콘택트렌즈를 코팅함으로써 광투과율이 감소하였으며 이중 코팅 렌즈가 단층보다 광투과율이 다소 감소하였다. 항생제 종류 및 LBL 코팅에 따라 시료들의 광투과율 차이가 있었으며, 코팅을 진행한 CAA, CHA, CAAP, CHAP는 ISO 18369의 가시광선 광투과율 기준인 95%에 미치지 못하였으나 모든 콘택트렌즈의 광투과율이 콘택트렌즈 국제기준인 ANSI Z80.20(2004)의 광투과율 기준인 88%를 충족했으므로 콘택트렌즈로의 활용 가능성을 확인하였다.
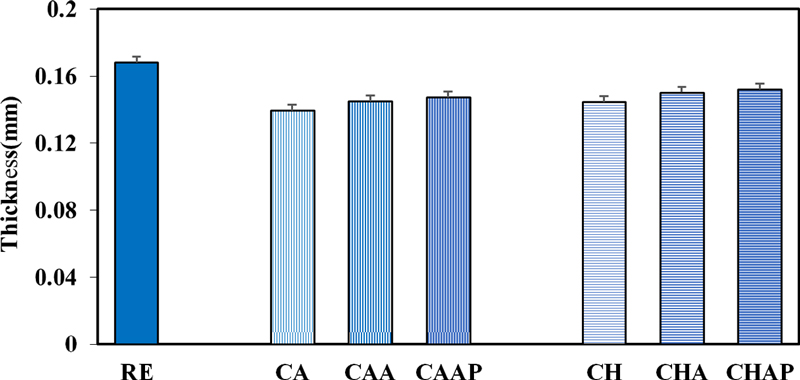
고분자인 알지네이트와 폴리아크릴산으로 단계별 LBL 코팅에 따라 콘택트렌즈의 두께를 측정하여 Fig. 5에 나타내었다. RE의 두께는 0.168 mm이며, 항생제만 포함한 CA와 CH는 각각 0.139 mm와 0.144 mm로 RE보다 감소하였다. 이와 같이 항생제가 포함된 시료의 두께가 감소하는 것은 카페인산과 클로로겐산의 -OH기와 -COOH기가 물분자와 상호작용하여 렌즈의 구조적 강도가 낮아져 더 얇아졌기 때문이다.[25] LBL 코팅에 따른 콘택트렌즈의 두께는 단층 코팅한 CAA, CHA가 0.145 mm, 0.150 mm였으며, 이중 코팅한 CAAP, CHAP는 0.147 mm, 0.152 mm로 나타났다. CA, CH와 비교하였을 때 코팅된 렌즈의 두께가 증가하였고, 단층과 이중층의 두께 차이는 거의 없었다.
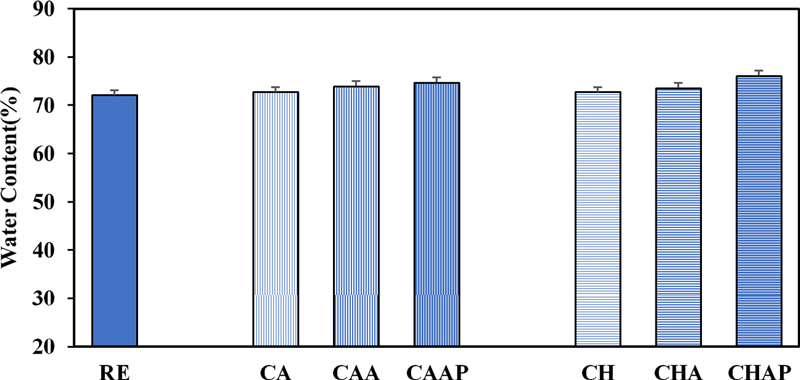
함수율은 콘택트렌즈의 착용감과 물리적 특성에 많은 영향을 주는 요소 중 하나다. 콘택트렌즈의 함수율을 측정한 결과를 Fig. 6에 나타내었다. 실리콘 모노머인 SiGMA의 존재에도 불구하고 항생제의 종류와 LBL 코팅층에 상관없이 모든 콘택트렌즈의 함수율은 70% 이상으로 높게 나타났다. 이는 친수성 단량체인 NVP, DMA의 존재 때문으로 분석된다. 약물을 포함한 CA와 CH의 함수율은 각각 72.83%, 71.57%로 RE와의 차이가 크지 않았다. 고분자로 단층 코팅한 CAA, CHA는 각각 73.97%, 73.62%로 RE에 비해 증가하였다. 또한 이중 코팅된 CAAP, CHAP의 함수율도 74.73%, 76.17%로 나타나 코팅층 수가 많을수록 함수율이 증가하였다. 이는 알지네이트와 폴리아크릴산이 친수성 작용기를 포함하고 있어 함수율이 증가한 것으로 보인다.[26,27]
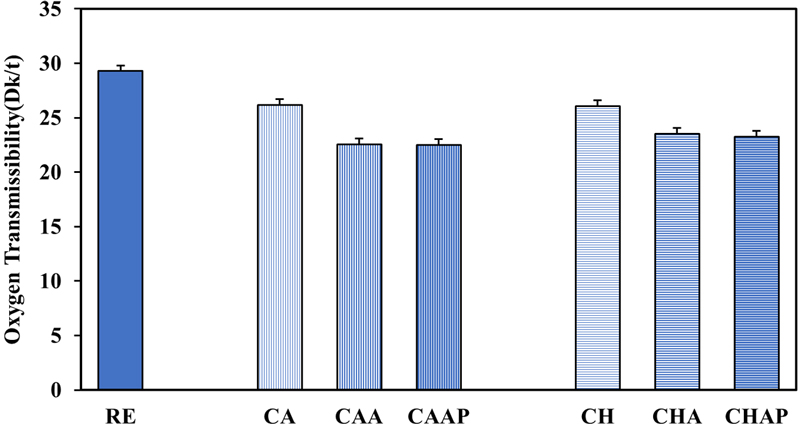
콘택트렌즈의 산소전달율(10-9(cm×mlO2)/(sec×mL×mmHg), Dk/t)은 각막의 산소 공급에 직접적인 영향을 주어 각막대사에 영향을 미치므로 콘택트렌즈 평가에 있어서 가장 중요한 요소중 하나이다. 항산화제 종류와 LBL코팅에 따른 콘택트렌즈 산소전달율 측정 결과를 Fig. 7에 나타내었다. 기본 콘택트렌즈인 RE의 산소전달율은 29.29 Dk/t을 나타내었으며 항생제를 포함한 CA, CH의 경우 각각 26.22 Dk/t, 26.10 Dk/t 로 RE에 비해 10%가량 감소되었다. 고분자로 단층 코팅된 CAA, CHA는 각각 22.60 Dk/t, 23.55 Dk/t이며, 이중 코팅한 CAAP, CHAP는 22.51 Dk/t, 23.31 Dk/t 로 단층 코팅된 시료들과 거의 비슷한 값을 나타내었다. LBL 코팅은 산소전달율을 감소시키지만, 코팅층 증가에 따른 영향은 별로 없었다. 이와 같이 단층과 이중층 시료의 산소전달율 차이가 없는 것은 콘택트렌즈의 두께 변화가 거의 없었기 때문으로 분석된다.
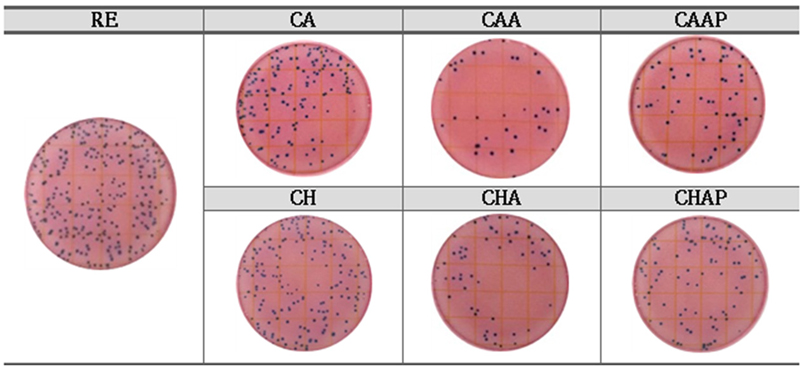
카페인산과 클로로겐산이 포함된 콘택트렌즈와 친수성 고분자를 이용한 LBL 코팅층에 따른 항균성을 평가 비교하여 Fig. 8에 나타내었다. 항산화제를 포함하지 않은 기본 렌즈 RE는 셀 수 없을 정도로 무수히 많은 균(too numerous to count: TNTC)이 자라 항균성이 없는 것을 확인하였다. 반면에 카페인산과 클로로겐산이 포함된 CA, CH 콘택트렌즈에서는 대장균 수가 감소하여 96.66CFU/ml과 92.33CFU/ml로 나타났다. 알지네이트로 LBL코팅한 CAA, CHA 콘택트렌즈의 균 수는 각각 33.66 CFU/ml, 58.33 CFU/ml로 가장 높은 항균 효과를 보였으며, 그 이유는 천연 다당류인 알지네이트가 음이온화된 카복실 그룹(-COO)에 의해 항균성이 발생하여 E. Coli에 대한 항균 효과를 가지기 때문이다.[28] 알지네이트와 폴리아크릴산으로 이중층을 형성한 콘택트렌즈의 균 수는 약물에 따라 각각 59.33 CFU/ml, 88.66 CFU/ml로 CAA, CHA에 비해 균 수가 증가하여 낮은 항균성을 보였는데, 이는 폴리아크릴산은 자체적인 항균성이 없으며 알지네이트로 코팅한 렌즈에 비해 더 촘촘한 네트워크 구조를 형성하여 약물의 용출이 어렵기 때문으로 분석된다.[29]
3. 항생제 종류와 고분자 코팅에 따른 콘택트렌즈의 표면 분석
약물을 포함하지 않는 RE와 약물이 포함된 CA, CH, 그리고 친수성 고분자로 LBL을 진행한 CAA, CHA, CAAP, CHAP 콘택트렌즈의 표면분석을 위하여 이미지화한 콘택트렌즈의 표면을 Fig. 9에 나타내었다. 주사전자현미경(SEM)을 통해 콘택트렌즈의 표면을 살펴보면 항산화제 첨가 유무에 상관없이 LBL코팅을 진행하지 않은 RE, CA, CH 시료의 표면이 매끄러운 것을 알 수 있었다. 알지네이트로 LBL층을 형성한 CAA, CHA는 RE 렌즈에 비해 거친 표면을 나타내고 있으며, 다양한 크기의 입자들이 불규칙하게 분포되어 있음을 알 수 있었다. 알지네이트와 폴리아크릴산으로 LBL층을 형성한 CAAP, CHAP의 경우 불규칙한 물결무늬를 나타내었다.
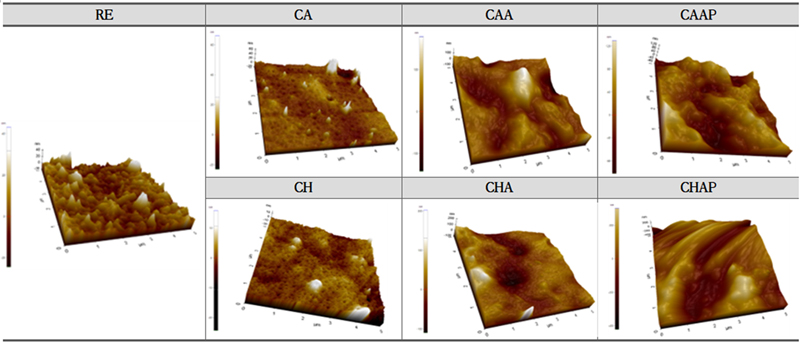
약물의 유무와 LBL 코팅층 변화에 따른 콘택트렌즈의 표면분석을 위하여 Fig. 10에 나타내었다. 원자힘현미경(AFM)을 통해 RE의 표면 거칠기를 확인한 결과 6.142 nm이었다. 카페인산과 클로로겐산을 포함한 CA, CH의 표면 거칠기는 각각 3.887 nm, 4.07 nm로 나타나 항산화제의 종류에 따른 차이는 없었다. 단층으로 코팅한 CAA, CHA의 표면 거칠기는 각각 24.617 nm, 25.596 nm이다. 이중 코팅한 CAAP, CHAP의 표면 거칠기는 각각 47.833 nm, 92.052 nm로 단층 코팅한 시료에 비해 표면거칠기가 많이 증가되었다. 고분자 LBL 코팅은 콘택트렌즈의 표면 거칠기를 증가시키며, 단층보다는 이중 코팅의 표면 거칠기가 더 크게 나타났다.
결 론
천연 항산화제인 카페인산과 클로로겐산이 함유되고 고분자인 알지네이트와 폴리아크릴산으로 LBL 코팅한 실리콘 하이드로겔 콘택트렌즈를 제작하였다. 실리콘 하이드로겔 콘택트렌즈는 높은 함수율을 나타내었으며 LBL 코팅으로 산소투과성은 다소 감소되었다. 고분자로 LBL 코팅된 콘택트렌즈는 항균성이 있으며, 카페인산과 클로로겐산이 포함된 콘택트렌즈는 항산화성이 있다. 고분자 LBL 코팅을 통해 콘택트렌즈의 항산화 지속시간이 향상됨을 확인하였다. 항산화제로 LBL 코팅된 콘택트렌즈는 일부 물리적 특성은 감소하였으나 약물의 방출 지속시간과 항균성을 향상하므로 치료용 콘택트렌즈로의 활용 가능성을 확인하였다.
Acknowledgments
본 연구는 2024년 대구가톨릭대학교 연구년 중 수행한 것임.
References
-
Caló E, Khutoryanskiy VV. Biomedical applications of hydrogels: a review of patents and commercial products. Eur Polym J. 2015;65:252-267.
[https://doi.org/10.1016/j.eurpolymj.2014.11.024]

-
Ahmed EM. Hydrogel: preparation, characterization, and applications: a review. J Adv Res. 2015;6(2):105-121.
[https://doi.org/10.1016/j.jare.2013.07.006]

-
Childs A, Li H, Lewittes DM, et al. Fabricating customized hydrogel contact lens. Sci Rep. 2016;6(1):34905.
[https://doi.org/10.1038/srep34905]

-
Lang JC. Ocular drug delivery conventional ocular formulations. Adv Drug Deliv Rev. 1995;16(1):39-43.
[https://doi.org/10.1016/0169-409X(95)00012-V]

-
Miyazaki S, Suzuki S, Kawasaki N, et al. In situ gelling xyloglucan formulations for sustained release ocular delivery of pilocarpine hydrochloride. Int J Pharm. 2001;229(1-2):29-36.
[https://doi.org/10.1016/s0378-5173(01)00825-0]

-
Ahmad Z, Salman S, Khan SA, et al. Versatility of hydrogels: from synthetic strategies, classification, and properties to biomedical applications. Gels. 2022;8(3):167.
[https://doi.org/10.3390/GELS8030167]

-
Hu X, Hao L, Wang H, et al. Hydrogel contact lens for extended delivery of ophthalmic drugs. Int J Polym Sci. 2011;2011(1):814163.
[https://doi.org/10.1155/2011/814163]

-
Nita M, Grzybowski A. The role of the reactive oxygen species and oxidative stress in the pathomechanism of age-related ocular diseases and other pathologies of the anterior and posterior eye segments in adults. Oxid Med Cell Longev. 2016;2016(1):3164734.
[https://doi.org/10.1155/2016/3164734]

-
Shahidi F, Zhong Y. Measurement of antioxidant activity. J Funct Foods. 2015;18(B):757-781.
[https://doi.org/10.1016/j.jff.2015.01.047]

-
Shahidi F, Amarowicz R. Antioxidant activity of protein hydrolyzates from aquatic species. J Am Oil Chem Soc. 1996;73(9):1197-1199.
[https://doi.org/10.1007/BF02523384]

-
Embuscado ME. Spices and herbs: natural sources of antioxidants - a mini review. J Funct Foods. 2015;18(B):811-819.
[https://doi.org/10.1016/j.jff.2015.03.005]

-
Sato Y, Itagaki S, Kurokawa T, et al. In vitro and in vivo antioxidant properties of chlorogenic acid and caffeic acid. Int J Pharm. 2011;403(1-2):136-138.
[https://doi.org/10.1016/j.ijpharm.2010.09.035]

-
Stefanello N, Spanevello RM, Passamonti S, et al. Coffee, caffeine, chlorogenic acid, and the purinergic system. Food Chem Toxicol. 2019;123:298-313.
[https://doi.org/10.1016/j.fct.2018.10.005]

-
Kim SR, Jung YR, Kim DH, et al. Caffeic acid regulates LPS-induced NF-κB activation through NIK/IKK and c-Src/ERK signaling pathways in endothelial cells. Arch Pharm Res. 2014;37(4):539-547.
[https://doi.org/10.1007/s12272-013-0211-6]

-
Huang J, Xie M, He L, et al. Chlorogenic acid: a review on its mechanisms of anti-inflammation, disease treatment, and related delivery systems. Front Pharmacol. 2023;14:1218015.
[https://doi.org/10.3389/fphar.2023.1218015]

-
Santana-Gálvez J, Villela Castrejón J, Serna-Saldívar SO, et al. Anticancer potential of dihydrocaffeic acid: a chlorogenic acid metabolite. CyTA J Food. 2020;18(1):245-248.
[https://doi.org/10.1080/19476337.2020.1743762]

-
Khan F, Bamunuarachchi NI, Tabassum N, et al. Caffeic acid and its derivatives: antimicrobial drugs toward microbial pathogens. J Agric Food Chem. 2021;69(10):2979-3004.
[https://doi.org/10.1021/acs.jafc.0c07579]

-
Choi D, Hong J. Layer-by-layer assembly of multilayer films for controlled drug release. Arch Pharm Res. 2014;37(1):79-87.
[https://doi.org/10.1007/S12272-013-0289-X]

-
Rykowska I, Nowak I, Nowak R. Soft contact lenses as drug delivery systems: a review. Molecules. 2021;26(18):5577.
[https://doi.org/10.3390/molecules26185577]

-
Yang H, Zhao M, Xing D, et al. Contact lens as an emerging platform for ophthalmic drug delivery: a systematic review. Asian J Pharm Sci. 2023;18(5):100847.
[https://doi.org/10.1016/j.ajps.2023.100847]

-
Zhao L, Song J, Du Y, et al. Therapeutic applications of contact lens-based drug delivery systems in ophthalmic diseases. Drug Deliv. 2023;30(1):2219419.
[https://doi.org/10.1080/10717544.2023.2219419]

-
Chen JH, Ho CT. Antioxidant activities of caffeic acid and its related hydroxycinnamic acid compounds. J Agric Food Chem. 1997;45(7):2374-2378.
[https://doi.org/10.1021/JF970055T]

-
Zhang J, Zhu Y, Song J, et al. Novel balanced charged alginate/PEI polyelectrolyte hydrogel that resists foreign-body reaction. ACS Appl Mater Interfaces. 2018;10(8):6879-6886.
[https://doi.org/10.1021/ACSAMI.7B17670]

-
Farah A, Monteiro M, Donangelo CM, Lafay S. Chlorogenic acids from green coffee extract are highly bioavailable in humans. J Nutr. 2008;138(12):2309-2315.
[https://doi.org/10.3945/jn.108.095554]

-
Bhamra TS, Tighe BJ. Mechanical properties of contact lenses: the contribution of measurement techniques and clinical feedback to 50 years of materials development. Cont Lens Anterior Eye. 2017;40(2):70-81.
[https://doi.org/10.1016/j.clae.2016.11.005]

-
Berger FM, Ludwig BJ, Wielich KH. The hydrophilic and acid binding properties of alginates. Am J Dig Dis. 1953;20(2):39-42.
[https://doi.org/10.1007/BF02897313]

-
Elhady MA, Mousaa IM, Attia RM. Preparation of a novel superabsorbent hydrogel based on polyacrylic acid/shellac using gamma irradiation for adsorption removal of malachite green dye. Polym Polym Compos. 2022;30(1):1-10.
[https://doi.org/10.1177/09673911221074435]

-
Shin WY, Lee HM. Changes in the characteristics of contact lenses with networks of alginate and carrageenan. J Korean Ophthalmic Opt Soc. 2023;28(3):191-197.
[https://doi.org/10.14479/jkoos.2023.28.3.191]

-
Arkaban H, Barani M, Akbarizadeh MR, et al. Polyacrylic acid nanoplatforms: antimicrobial, tissue engineering, and cancer theranostic applications. Polymers. 2022;14(6):1259.
[https://doi.org/10.3390/polym14061259]